ЕАЭО елдерінің бірыңғай фармацевтикалық нарығын құру. Пациенттер қандай пайда көреді?

ЕАЭО-ға мүше елдерде ұлттық рәсімдер бойынша тіркелген барлық дәрі-дәрмектер Еуразиялық экономикалық одақ ережелерімен сәйкестендірілуі тиіс болатын өтпелі кезеңнің аяқталуына аз ғана уақыт қалды. Ол 2025 жылғы 31 желтоқсанда аяқталады, ал әрі қарай нарықта Одақ талаптары бойынша тіркеу рәсімінен өткен дәрі-дәрмектер ғана қалады. Бұл процесс ауқымды әрі елдеріміздің денсаулық сақтау жүйелері мен пациенттері үшін өте маңызды, сондықтан мамандар мен сала қатысушыларын оның қалай жүріп жатқаны алаңдатады. «Қазақстанның фармацевтикалық шолуы» ақпараттық-талдамалық басылымының редакциясы қазіргі уақытта елдер бойынша тіркеу көрінісінің қандай болып жатқаны, өтінім берушілер мен реттеушілердің қандай қиындықтарға кезігетіні, дәрі-дәрмектерді тұтынушылардың қандай пайда көруі мүмкін екені туралы сұрақтармен Еуразиялық экономикалық комиссия Алқасына жүгінді. Біздің сұрақтарымызға ЕЭК Техникалық реттеу және аккредиттеу департаменті директорының орынбасары МАМБЕТАЛИЕВА Чинара Мырзакматовна жауап берді.
- Құрметті Чинара Мырзакматовна, ЕАЭО аясында дәрі-дәрмектерді тіркеу процесі қаншалықты белсенді жүріп жатқанын айтып өтсеңіз.
- Дәрі-дәрмектерді тіркеудің кез келген түрі (бастапқы тіркеу, тіркеуді растау, тіркеу дерекнамасына өзгерістер енгізу, тіркеу дерекнамасын Одақ заңнамасымен сәйкестікке келтіру) – бастамалық процесс. Ол өтінім берушілердің бастамасымен жүзеге асырылады. Сондықтан бұл жағдайда процестің белсенділігі реттеушілерге емес, өндірушілердің өздеріне байланысты болады. Соңғы екі жылда барлық мүше мемлекеттерде өтінім берушілердің одақтық сегментке өту процестері жеделдей түсті, жалпы алғанда, дәрі-дәрмектердің 80%-дан астамы одақтық ережелерге көшіріліп үлгерді. Қазақстан Республикасы Одақ ережелері бойынша тіркеу куәлігін алғашқы болып бергенімен, кейін жұмыс қарқынын бәсеңдетті. Өтпелі кезеңнің аяқталуына (2025 жылғы 31 желтоқсанға дейін) әлі уақыт бар, барлық елдерде өтінім беру белсенділігі артып келеді, осы уақытты құжаттарды дайындауға жұмсап, ұлттық ережелер бойынша дәрілік препаратпен жұмыс істеу тәжірибесі ескерілетін сәйкестікке келтірудің қарапайым рәсімін қолдану керек.
– Қазіргі таңда ЕАЭО ережелері бойынша қанша дәрі-дәрмек тіркелді? Қанша өтінім қарастырылуда? Елдер бойынша тіркеу көрінісі қандай болып жатыр?
- 2024 жылғы тамыз айының соңындағы ахуал бойынша, жиынтық саны 11 000-нан асатын өтінім қарастырылуда (оның 80%-ға жуығын – дәрілік препаратты тіркеу дерекнамасын Одақ заңнамасымен сәйкестікке келтіруге берілген өтінімдер және 20%-ын Одақ ережелері бойынша дәрілік препараттарды бастапқы тіркеуге берілген өтінімдер құрайды). Тіркеумен қатар, тіркеу дерекнамасына өзгерістер енгізу процесі де жүреді (және бұл міндетті түрде болуы тиіс, өйткені дәрілік препараттардың дерекнамасы үнемі өзектілендіріліп отырады).
Аталмыш кезеңде елдерде тіркеу дерекнамасына өзгерістер енгізуге берілген 8 001 өтінім қарастырылды.
2024 жылғы тамыз айының соңындағы ахуал бойынша, тараптар барлығы 6 642 тіркеу куәлігін берді. Мүше мемлекеттер бойынша өтінімдердің қаралуы және тіркеу куәліктерінің берілуі туралы деректер суретте көрсетілген.
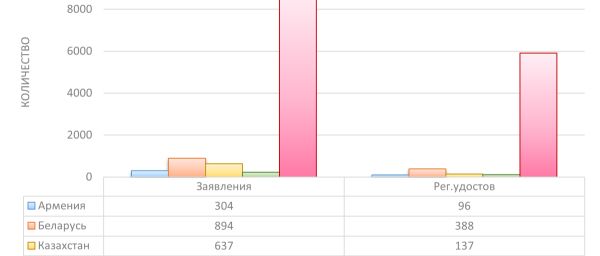
Сурет. Әрбір мүше мемлекетте берілген тіркеу куәліктерінің және дәрілік препараттарды тіркеуге өтінімдердің саны (тіркеу дерекнамасына өзгерістер енгізуге берілген өтінімдерді есепке алмағанда)
– Бірыңғай ережелер бойынша дәрі-дәрмектерді тіркеумен байланысты негізгі мәселелер мен қиындықтар қандай?
– Бұған дейін Одақтың бірыңғай ақпараттық жүйесінің жұмысындағы мәселелер туралы тезис көтерілген болатын. Бірақ 2022 жылдан бастап жүйе жұмысы жолға қойылып, тізілімге деректерді беру тізілімдік жазбалар түрінде жүзеге асырыла бастады және оны тіпті интеграциялық шлюзі шағын болғандықтан, толық дерекнаманы беруде қиындықтарға ұшырайтын мүше мемлекеттер де жүргізе алатын болды.
2022 жылдың соңынан бастап Комиссия ақпараттық жүйе үшін жаңартылған бағдарламалық жасақтама дайындады және оны сынақтан өткізуге қанша уақыт кететіні тараптардың өздеріне ғана байланысты. Жаңартылған бағдарламалық жасақтаманы сынақтан өткізуді Армения Республикасы мен Қазақстан Республикасының барынша белсенді жүргізіп жатқанын атап өткен жөн, бірақ олар да кестеден артта қалып отыр.
2023-2024 жылдары Одақ заңнамасымен сәйкестікке келтіру үшін тіркеу дерекнамасын дайындау процесінде ауқымды өзгерістер болды.
Мұндай тіркеу дерекнамаларының құрамы 50%-дан астамға қысқартылды (бұл ретте модульдер бойынша материал көлемдерінің азаюы: 1-ші модуль үшін – 70%-дан астам, 2-ші модуль үшін – 80%-дан астам, 3-ші модуль үшін – 40 %-дан астам, 4-ші және 5-ші модульдер үшін 90%-дан астам шаманы құрады). Іс жүзінде қазір бұл рәсім ғылыми-сараптамалық сипаттан гөрі, әкімшілік сипатқа көбірек ие болып отыр. Өтінім берушіге барлық мемлекеттер тізбегінде жұмыстың аяқталуын күтпестен, дерекнаманы үнемі өзектілендіріп отыру (оған өзгерістер енгізу) құқығы берілді.
Сондықтан, қазіргі уақытта Комиссияның көріп отырғанындай, тіркеумен байланысты негізгі қиындық – өтінім берушілердің қалған уақытта белсенділік танытып, нарықтың одақтық сегментіне көшу үшін өздеріне берілген мүмкіндіктерді барынша өз пайдасына асыра алуы.
– Дәрі-дәрмектерді тұтынушылар бірыңғай фармацевтикалық нарық құрудан қандай пайда көруі мүмкін? Дәрі-дәрмектерге қол жеткізумен байланысты ықтимал тәуекелдер бар ма?
– Бірыңғай нарық дәрілік препараттарды нарыққа шығарумен байланысты шығындарды азайтудың бірегей мүмкіндігін береді. Бір-бірін қайталайтын 5 клиникалық зерттеуді (ал түпнұсқалық дәрі-дәрмектер үшін – клиникаға дейінгі зерттеу бағдарламаларын да) қайталаудың орнына, 5 түрлі сипаттаманы, дәрілік препараттың сапасын бақылау әдістемелерін дайындаудың, нарыққа 5 түрлі құрамды шығарудың орнына (өйткені мүше мемлекеттердің талаптары арасында рұқсат етілетін қосалқы заттектер бойынша сәйкессіздіктер болды) өтінім беруші бір тіркеу дерекнамасын құруға және жүргізуге құқылы болады.
5 тіркеу дерекнамасын жүргізуге (өзгерістер енгізуге) жұмсалатын шығындар барынша азайтылды. Өтінім берушіге барлық бес мүше мемлекеттің GMP, GCP, GLP, GVP сәйкестігіне тексеруден өту қажет болмайды. Одаққа мүше мемлекеттің фармацевтикалық инспектораты жүргізген бір тексеру нәтижелері ЕАЭО-ның барлық мемлекеттерінде мойындалады. Бұл, сонымен қатар, мүше мемлекеттердегі реттеушілер мен инспекторларға түсетін жүктемені де азайтты, ал өзара тәжірибе алмасу мүмкіндігі олардың кәсіби деңгейін арттырады.
Дәрі-дәрмектердің қарапайым тұтынушысы мұны қалай сезінуі мүмкін:
1) тұтынушы Одақ нарығына шығатын сапалы, тиімді және қауіпсіз дәрілік препараттарға қол жеткізе алады, өйткені Одақта дәрілік препараттардың айналымына қойылатын барлық талаптар ең жақсы халықаралық тәжірибелермен үйлестірілген;
2) дәрі-дәрмектерді нарыққа шығаруға және тіркеу дерекнамасын жүргізуге кететін шығындар мен уақытты барынша азайту дәрі-дәрмектерді сатып алу құнына әсер етеді және бұл тұтынушы үшін нарықтың ең басты оң әсері болуы мүмкін;
3) бірыңғай дерекнама тек бір мемлекеттегі пациенттер популяциясын ғана емес, бес мемлекеттегі пациенттердің біріккен популяцияларын емдеуге арналған бірыңғай дәрілік препаратты нарыққа шығаруға мүмкіндік береді. Бірқатар заманауи препараттар үшін шағын топтамалармен шығару тиімсіз болады. Бірыңғай нарық бірыңғай дерекнаманың арқасында Одақтың барлық пациенттері үшін препарат шығаруға мүмкіндік береді, демек, пациенттерге арналған заманауи препараттардың дәріханаларға келіп түсуі де жеделдетіліп, олардың жаңа дәрі-дәрмектермен емдеуді күту уақытын азайтады.
Бірыңғай нарықтың пайдасы (нарықта тиімділігі мен қауіпсіздігі дәлелденген дәрі-дәрмектер үлесінің артуынан бастап мүше мемлекеттердің логистикасы мен фармацевтикалық өнеркәсібін дамыту мәселелеріне дейін) туралы тағы көптеген мысалдар келтіруге болады, бірақ қарапайым пациент, дәрі-дәрмектердің қарапайым тұтынушысы үшін бұл әсерлердің барлығы жоғарыда айтылғандардай байқала қоймайды.
– Чинара Мырзакматовна, бәрін қамтып, егжей-тегжейлі жауап бергеніңізге көп рахмет.
Ольга Байымбетова сұрақтар қойды.
Фото ЕЭК Алқасының баспасөз қызметінен алынды.

 English
English العربية
العربية 简体中文
简体中文 Français
Français Русский
Русский Español
Español Қазақ тілі
Қазақ тілі