Создание единого фармацевтического рынка стран ЕАЭС. Какие выгоды получат пациенты?

Осталось не так много времени до окончания переходного периода, когда все лекарственные средства, зарегистрированные в странах-членах ЕАЭС по национальным процедурам, должны будут приведены в соответствие с правилами Евразийского экономического союза. Закончится он 31 декабря 2025 года, ну, а далее на рынке останутся только те лекарства, которые пройдут процедуры регистрации по требованиям Союза. Процесс – масштабный и очень значимый для систем здравоохранения и пациентов наших стран, поэтому специалистов и участников отрасли волнует то, как он протекает. С вопросами о том, как выглядит картина по регистрации по странам на данный момент, с какими вызовами сталкиваются заявители и регуляторы, какие потенциальные выгоды получат потребители лекарств редакция информационно-аналитического издания «Фармацевтическое обозрение Казахстана» обратилась в Коллегию Евразийской экономической комиссии. На наши вопросы ответила заместитель директора Департамента технического регулирования и аккредитации ЕЭК Чинара Мырзакматовна МАМБЕТАЛИЕВА.
- Уважаемая Чинара Мырзакматовна, скажите, насколько активно идет процесс регистрации лекарственных средств в рамках ЕАЭС?
- Регистрация лекарственных средств в любом ее виде (первичная регистрация, подтверждение регистрации, внесение изменений в регистрационное досье, приведение регистрационных досье в соответствие с правом Союза) – это инициативный процесс. Осуществляется он по инициативе заявителей. Поэтому, активность процесса в данном случае определяется самими производителями, а не регуляторами. В последние два года ускорились процессы перехода в союзный сегмент заявителей и во всех государствах-членах, суммарно уже более 80% лекарственных препаратов переведены на союзные правила. Республика Казахстан, хотя и была первой, кто выдал регистрационное удостоверение по правилам Союза, позже сбавила темпы работ. Время до конца переходного периода (31 декабря 2025 года) пока еще есть, активность подач растет во всех странах, и следует это время потратить на подготовку документов и воспользоваться более простой процедурой приведения в соответствие, в которой учитывается опыт обращения лекарственного препарата по национальным правилам.
- Сколько на сегодняшний лекарственных средств зарегистрировано по правилам ЕАЭС? Сколько заявок находится на рассмотрении? Как выглядит картина по регистрации по странам?
- По состоянию на конец августа 2024 года, на рассмотрении накопительным итогом находилось более 11 000 заявлений (из них около 80% – составляют заявления на приведение регистрационного досье лекарственного препарата в соответствие с правом Союза и 20% - заявлений на первичную регистрацию лекарственных препаратов по правилам Союза). Параллельно с регистрацией (и это неизбежно, поскольку досье лекарственных препаратов непрерывно актуализируется) проходит и процесс внесения изменений в регистрационные досье.
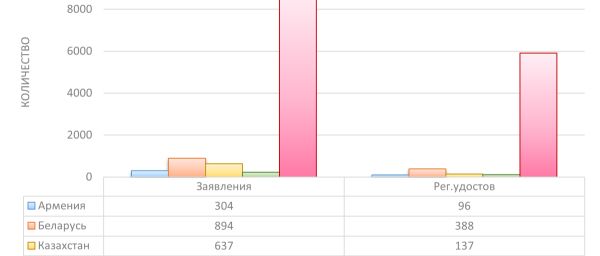
На рассмотрении в странах на указанный период находилось 8 001 заявление на внесение изменений в регистрационное досье. Всего же по состоянию на конец августа 2024 года сторонами выдано 6 642 регистрационных удостоверений. Данные о рассмотрении заявлений по государствам-членам и выдаче регистрационных удостоверений показаны на рисунке.
Рисунок. Количество выданных регистрационных удостоверений и заявлений на регистрацию лекарственных препаратов в каждом из государств-членов (без учета заявлений на внесение изменений в регистрационные досье)
- Каковы основные проблемы и вызовы, связанные с регистрацией лекарств по единым правилам?
- Ранее выдвигался тезис о проблемах в работе единой информационной системы Союза. Но, с 2022 года работа системы была отлажена, передача данных в реестр стала осуществляться в виде реестровых записей и позволяла ее проводить даже государствам-членам с небольшими размерами интеграционных шлюзов, для которых было проблемно осуществить через малый шлюз передачу полного досье.
С конца 2022 года Комиссия подготовила обновленное программное обеспечение для информационной системы и только от сторон зависит то, в какие сроки проведут его тестирование. Надо отметить, что наиболее активно тестирование обновленного программного обеспечения осуществляют Республика Армения и Республика Казахстан, но и они отстают от графика.
В 2023-2024 годах произошли масштабные изменения в процессе подготовки регистрационного досье для приведения его в соответствие с правом Союза.
Состав таких регистрационных досье сократили более чем на 50% (при этом сокращение объемов материала составило по модулям: для модуля 1 - более 70%, для модуля 2 – более 80%, для модуля 3 – более 40%, для модулей 4 и 5 – более 90%). Фактически, сейчас данная процедура носит больше административный, чем научно-экспертный характер. Заявителю предоставили право непрерывной актуализации досье (внесения в него изменений) не дожидаясь окончания работ во всей цепочке государств признания.
Поэтому, как представляется сейчас Комиссии, основной вызов, связанный с регистрацией, это необходимость заявителям обеспечить свою активность в оставшееся время и с максимальной пользой для себя использовать предоставленные им возможности перехода в союзный сегмент рынка.
- Какие потенциальные выгоды получат потребители лекарств от создания единого фармацевтического рынка? Имеются ли потенциальные риски, связанные с доступностью лекарств?
- Единый рынок предоставляет уникальную возможность сокращений издержек, связанных с выводом лекарственных препаратов на рынок. Вместо повторения 5 дублирующих друг друга клинических исследований (а для оригинальных лекарств – и доклинических программ исследований), вместо подготовки 5 разных спецификаций, методик контроля качества лекарственного препарата, выпуска на рынок 5 разных составов (т.к. между требованиями государств-членов были расхождения в допустимых вспомогательных веществах) заявитель получат право создать и поддерживать одно регистрационное досье.
Минимизировались затраты на поддержание (внесение изменений) в 5 регистрационных досье. Заявителю не требуется проходить инспектирование на соответствие GMP, GCP, GLP, GVP всеми пятью государствами-членами. Результаты одной инспекции, выполненной фармацевтическим инспекторатом государства-члена Союза, – признаются всеми государствами ЕАЭС. Это также снизило нагрузку на регуляторов и инспекторов государств-членов, а возможность обмена опытом взаимно повышает их профессионализм.
Как же это сможет прочувствовать простой потребитель лекарств:
1) потребитель получит доступ к качественным, эффективным и безопасным лекарственным препаратам, которые будут выходить на рынок Союза, поскольку все требования к обращению лекарственных препаратов в Союзе гармонизированы с наилучшими международными практиками;
2) минимизация затрат и времени на вывод лекарств на рынок и поддержание регистрационного досье отразится на закупочной стоимости лекарств и это, наверное, самый главный для потребителя положительный эффект рынка;
3) единое досье позволяет выпускать на рынок единый лекарственный препарат, предназначенный для лечения популяции пациентов не только в одном государстве, а для объединенных популяций пациентов в пяти государствах. Для ряда современных препаратов, выпуск малыми сериями невыгоден. Единый рынок, за счет единого досье позволяет выпустить препарат для всех пациентов Союза, а значит ускорить поступление в аптеки современных препаратов для пациентов сократив им время ожидания новой фармакотерапии.
Можно приводить еще много примеров пользы единого рынка (начиная от повышения доли доказано эффективных и безопасных лекарств на нем и заканчивая вопросами развития логистики и фармпрома государств-членов), но все эти эффекты не так заметны для простого пациента, простого потребителя лекарств, как те, о которых было сказано выше.
- Чинара Мырзакматовна, спасибо Вам больше за столь исчерпывающие ответы.
Вопросы задавала Ольга Баимбетова.
Фото предоставлено пресс-службой Коллегии ЕЭК.