ГЛАВНЫЕ НОВОСТИ

Постановлением Правительства Республики Казахстан Муратов Тимур Муратович назначен на должность вице-министра здравоохранения. Об этом сообщает пресс-служба Правительства.
Родился в 1977 году в области Абай. Окончил Семипалатинскую государственную медицинскую Академию, Евразийский гуманитарный институт, Казахстанский медицинский университет «ВШОЗ».
Трудовую деятельность начал в 2001 году врачом-урологом в поликлинике №6 города Астаны.
В разные годы работал в оздоровительном центре «Ақ ниет», Главной военной поликлинике Министерства обороны, Национальном научном медицинском центре.
В 2010-2015 гг. – заведующий отделением, заместитель главного врача городской больницы №2 г. Астаны.
2015-2017 гг. – главный врач Акмолинской областной больницы №2.
2017-2018 гг. – заместитель руководителя Управления здравоохранения г. Астаны.
2018-2019 гг. – главный врач Станции скорой медицинской помощи г. Астаны.
В 2019-2020 гг. был первым заместителем Больницы Медицинского центра Управления делами Президента.
С 2020 по 2023 гг. – руководитель Управления общественного здравоохранения г. Астаны.
С 2023 г. по настоящее время – председатель Правления Национального координационного центра экстренной медицины МЗ РК.
Фото: Официальный интернет-ресурс Правительства Республики Казахстан.
Источник: Официальный интернет-ресурс Правительства Республики Казахстан.

29 октября 2024 года свой юбилей отмечает Сакипова Зуриядда Бектемировна, доктор фармацевтических наук, профессор, декан Школы фармации Казахского национального медицинского университета имени С.Д. Асфендиярова, отличник здравоохранения Республики Казахстан.
Профессор Сакипова З.Б. является выдающимся талантливым ученым и педагогом. Она внесла большой вклад в подготовку квалифицированных фармацевтических научных кадров и развитие отечественной фармацевтической науки и практики.
Зуриядда Бектемировна - член Экспертного Совета Национального центра экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники Минздрава РК, участник международных совещаний Фармакопей Мира (International meeting of World Pharmacopoeias, World Health Organization: Geneva, Delhi, Baltimore, Xi’an), член Фармакопейного комитета Евразийского экономического союза, участник международной деятельности по созданию Фармакопейного индекса, участник сессий Европейской Фармакопейной Комиссии, отличник здравоохранения РК, Лауреат Международной премии GUSI 2015. Обладатель международного научного гранта NAWA. Член Фитохимического общества Азии.
Сакипова З.Б. окончила с отличием Павлодарское медицинское училище по специальности фармацевт (1980-83 гг.), а затем, поступила на факультет фармации Алма-Атинского государственного медицинского института (ныне Казахский национальный медицинский университет им. С.Д. Асфендиярова (КазНМУ, Алматы). После продолжила образование в качестве стажера-исследователя (1988-1996) и окончила аспирантуру в 1999 году. В 2000 году защитила диссертацию на соискание ученой степени кандидата фармацевтических наук, а в 2010 году – диссертацию на соискание ученой степени доктора фармацевтических наук.
Зуриядда Бектемировна более 25 лет работает в Казахском национальном медицинском университете имени С.Д. Асфендиярова. С 2011 года она руководила кафедрой технологии лекарств. С 2016 года стала деканом Школы Фармации. Своим трудом она вносит большой вклад в подготовку, переподготовку квалифицированных кадров для здравоохранения, фармации. Велика ее роль и в подготовке научных кадров: докторантов и магистрантов научно-педагогического и профильного направления специальностей «Фармация» и «Технология фармацевтического производства».
Под руководством Сакиповой З.Б. реализовано более 5 научных проектов и опубликовано более 200 научных и учебно-методических трудов, в том числе 17 статей в международных рецензируемых научных журналах информационной базы компании Thomson Reuters и Scopus. Является обладателем более 35 патентов в области разработки лекарственных средств, из них внедрено в производство – 14. Подготовила 7 докторантов и 25 магистрантов.
Одним из важных направлений педагогической деятельности Сакиповой З.Б. является создание и внедрение в учебный процесс программ по современным надлежащим фармацевтическим практикам, фармкосметологии путем организации совместных тренингов, лекций и семинаров ведущими профессионалами этой области.
В 2015 году Сакипова З.Д была удостоена высокой награды - Премии Мира GUSI (азиатский аналог Нобелевской премии). Впервые в истории нашей страны эта награда была вручена ученому из Казахстана. Премия была вручена за научные достижения, выдающиеся результаты в области фундаментальных и прикладных исследований фармации и медицины Казахстана, в целях улучшения жизни людей и поиска оригинальных разработок лекарственных препаратов во имя благосостояния и здоровья народа, за подготовку докторантов и магистрантов в рамках совместных международных научных исследований, а также сотрудничество с ведущими университетами мира.
Профессор Сакипова З.Б. активно участвует в развитии фармацевтической науки в РК путем расширения международного сотрудничества и обмена опытом с ведущими международными высшими учебными заведениями России, Украины, Ирландии, Польши, Чехии, Словакии, Китая и США.
Международное сотрудничество – важный компонент деятельности высших учебных заведений. Оно демонстрирует работу университета и задает стандарты мировых лидеров по изучению передовых тенденций и новых знаний, без которых невозможно представить современное образование.
Школа фармации КазНМУ им. С.Д. Асфендиярова - ведущая фармацевтическая школа Казахстана с богатой историей и научными традициями, занимающимся подготовкой конкурентоспособных профессионалов фармацевтической отрасли. Школа фармации имеет партнерские связи с ведущими университетами и научными центрами СНГ, Европы и Америки. Более 60 ведущих зарубежных ученых работали в период с 2011 года в рамках программы «Визитинг-профессор».
Успешно развивается сотрудничество Школы Фармации КазНМУ имени С.Д. Асфендиярова с ВУЗами-партнерами: Санкт-Петербургским государственным химико-фармацевтическим университетом (Россия); Литовским университетом наук о здоровье, г. Kaунас; Trinity College, Дублин (Ирландия); University of Mississippi, г. Оксфорд (США); University of Brighton, г. Брайтон (Великобритания); Medical University, г. Гданьск (Польша); Национальным фармацевтическим университетом, г. Харьков (Украина); Medical University, г. Люблин (Польша); University of Ljubljana, г. Любляна (Словения); High School of Informatics and Management, г. Жешув (Польша); Faculty of Pharmacy of Comenius University in Bratislava, г. Братислава, Словакия.
В 2011-2015 гг. Сакипова З.Б. участвовала в реализации проекта Министерства здравоохранения и социального развития РК по созданию Государственной фармакопеи Республики Казахстан.
Помимо научно-педагогической деятельности Сакипова З.Б. проводит оценку качества и безопасности лекарственных средств, при их государственной регистрации, в качестве эксперта департамента специализированной экспертизы лекарственных средств при Национальном центре экспертизы ЛС, ИМН и МТ МЗСР РК. Сакипова З.Б. является экспертом независимой организации по оценке качества образования высших учебных заведений по направлению «Фармация - Здравоохранение и социальное обеспечение».
Сакипова З.Б. приняла участие в более чем сорока тренингах, семинарах и лекциях, организованных ведущими компаниями Казахстана, России, Украины, Фармакопейной Конвенцией США, иностранными и отечественными фармацевтическими компаниями.
Зуриядда Бектемировна является победителем проекта Программы международного академического партнерства (NAWA) - Title of the Project: Cosmetic Valley – International Scientific and Implementation Cooperation at the Cosmetology Department от Национального агентства обмена знаниями (Польша).
С днем рождения, Вас, уважаемая Зуриядда Бектемировна!
Коллеги, ученики, медицинская и фармацевтическая общественность, зарубежные партнеры поздравляют Вас с юбилеем. Пусть сбываются мечты, умножаются возможности, успешно идут все дела, хватает сил и энергии для новых свершений! Чтобы в жизни было много смеха и успеха, много радости и счастья, много хороших людей и возможностей для исполнения мечты. Чтобы близкие ценили, коллеги уважали, друзья поддерживали. Благодарных и толковых учеников, новых проектов и коллабораций. Крепкого, могучего здоровья, позитивного настроения, веры в себя и в успех! Пусть благополучие и достаток будут в вашем доме. Здоровья и всех благ родным и близким.
Редакция издания «Фармацевтическое обозрение Казахстана» присоединяется к поздравлениям и от всей души желает Вам, Зуриядда Бектемировна здоровья и процветания!

Накануне Дня Республики Казахстан Указом Президента Касым-Жомарта Токаева за значительный вклад в социально-экономическое и культурно-духовное развитие страны, укрепление дружбы и сотрудничества между народами, активную общественную деятельность ряд граждан отмечен государственными наградами. В числе награжденных - видные деятели здравоохранения, внесшие значительный вклад в спасение жизни людей и развитие отечественной медицины.
Впервые в истории Независимого Казахстана по инициативе Главы государства за выдающиеся достижения и особые заслуги перед РК в области здравоохранения трем докторам страны присвоены звания «Қазақстанның еңбек сіңірген дәрігері» («Заслуженный врач Республики Казахстан»).
«Почетное звание «Қазақстанның еңбек сіңірген дәрігері», установленное в этом году, присуждено генеральному директору АО «Национальный научный медицинский центр» Абаю Кабатаевичу Байгенжину, руководителю Центра гематологии ТОО «Национальный научный онкологический центр» Вадиму Матвеевичу Кемайкину, врачу КГП «Областная клиническая больница» Карагандинской области Борису Валентиновичу Цхаю.
Орденом «Барыс» І степени награжден Локшин Вячеслав Нотанович – руководитель Международного центра клинической репродуктологии «PERSONA».
Орденом «Парасат» награждены
- Абдикалиулы Нурлан – руководитель отдела АО «Научно-исследовательский институт кардиологии и внутренних болезней»,
- Султаналиев Токан – главный консультант Центра многопрофильной хирургии ТОО «Национальный научный онкологический центр».
Орденом «Құрмет» награждены:
- Байдурин Серик Амангельдиевич – заведующий кафедрой НАО «Медицинский университет Астана»;
- Жумабаева Алтын Зурашевна – директор по сестринскому делу АО «Национальный центр нейрохирургии»;
- Жусупов Болатбек Зиябекович – профессор НАО «Медицинский университет Астана»;
- Кайдаров Бакыт Касенович – профессор НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова»;
- Куренова Гульнара Байбосыновна – и.о. заместителя директора по лечебной работе КГП на ПХВ «Городской перинатальный центр № 2» Управления общественного здоровья города Алматы;
- Оспанова Кульжами Есимхановна – профессор кафедры патологической анатомии НАО «Медицинский университет Астана».
От имени Главы государства государственные награды отличившимся работникам системы здравоохранения вручила заместитель Премьер-Министра РК Тамара Дуйсенова в ходе торжественного мероприятия «Мәңгі жаса, қыран елім – Қазақстаным», посвященное чествованию врачей, деятелей общественного здравоохранения, менеджеров отрасли.
Выступая на торжественном мероприятии, Тамара Дуйсенова подчеркнула значительные достижения, которых Казахстан достиг в сфере здравоохранения за последние годы.
«Отечественная система здравоохранения неуклонно развивается. По поручению Главы государства реализуется Национальный проект, направленный на повышение доступности медицинской помощи для сельских жителей. В рамках программы ведется строительство медицинских пунктов и врачебных амбулаторий. Это позволит улучшить доступность качественной медицинской помощи для населения», — отметила вице-премьер.
Тамара Дуйсенова также подчеркнула, что сегодня оказываются высокотехнологичные медицинские услуги. Среди них – уникальные операции на сердце, выполняемые в Национальном кардиохирургическом центре, которые уже спасли тысячи жизней. Этот опыт активно распространяется в регионах, что способствует повышению уровня медицинской помощи по всей стране.
Особое внимание вице-премьер уделила поддержке медицинских работников. В последние годы значительные ресурсы направлены на повышение заработной платы сотрудников системы здравоохранения, их социальную поддержку и создание комфортных условий для работы. В этом году впервые был учрежден почетный титул «Заслуженный врач Казахстана», что подчеркивает важность медицинской профессии для государства.
Источники: Официальные интернет-ресурсы Президента РК, Правительства РК и Министерства здравоохранения РК.
Фото: Официальный интернет-ресурс Правительства РК.
Мастер-классы
GDP талаптарына сәйкес фармацевтикалық өнім дистрибьюторының валидациясы мен біліктілік процесін ұйымдастыру
Алексей Хилюк, GDPЖол жобасының қатысушысы
Бұл мақала практикалық жұмыс тәжірибесіне негізделген. Осыған байланысты, GDPЖол жобасының қазіргі кеңесшілеріне Қазақстан, Өзбекстан және Ресейден мақала жазуға қатысқаны, әдістемелер, клиенттердің пікірлері туралы ақпарат бергені, сондай-ақ осы тақырыпты қамтудың маңыздылығы мен қажеттілігіне назар аударғаны үшін алғысымды білдіргім келеді.
Бұл мақалада біз валидация әдістемесін немесе валидация және біліктілік бойынша жұмыстарды жүргізудің нақты мысалдарын емес, нормативтік талаптарға сәйкес дистрибьютордың сапа жүйесі шеңберінде валидация және біліктілік процесін қалай ұйымдастыруға болатындығын талдаймыз.
Тексеру және біліктілік процесі GDP (Good distribution practice) талабына сәйкес дистрибьютордың сапа жүйесінің міндетті процесі болғандықтан, ең алдымен GDP ережелерінде көрсетілген анықтамалар мен талаптарға назар аудару қажет.
Осы мақалада біз Еуразиялық экономикалық комиссия кеңесінің 2016 жылғы 3 қарашадағы N 80 шешімімен бекітілген тиісті дистрибьюторлық практика ережелерінің талаптарын негізге алдық.
Бастау үшін GDP ережелерін тексеру және біліктілік терминдерінің анықтамаларын қарастырайық:
- "валидация" - рәсімнің, процестің, жабдықтың, материалдың, операцияның немесе жүйенің берілген талаптарға сәйкес келетіндігін және оларды пайдалану алдын ала белгіленген жарамдылық критерийлеріне сәйкес келетін нәтижелерге үнемі әкелетінін дәлелдейтін құжатталған әрекеттер;
- "біліктілік" - жабдықтың немесе көмекші жүйелердің дұрыс орнатылғанын, дұрыс жұмыс істейтінін және шынымен күтілетін нәтижелерге әкелетінін куәландыратын және растайтын құжатталған әрекеттер.
Енді GDP ережелерінің 50-тармағында не жазылғанына назар аударайық: «Ұйым тиісті монтаждау мен пайдалануды растау мақсатында біліктілікке және (немесе) валидацияға жататын негізгі жабдықтар мен процестерді айқындауға тиіс. Біліктілік және (немесе) валидация бойынша жүргізілетін жұмыстардың көлемі (мысалы, сақтау, жөнелтуге дайындау және буып-түю) тәуекелдерді құжаттамалық ресімделген талдау негізінде айқындалады.»
Осы талаптан валидация мен біліктілік кез келген процестің немесе жабдықтың берілген талаптарға сәйкес келетіндігін немесе дұрыс жұмыс істейтіндігін растайтын құжатталған тесттер ғана емес екендігі айқын болады. Валидация және біліктілік - бұл басқа процестермен байланысты дистрибьютордың сапа жүйесінің қажетті процесі (мысалы, тәуекелдерді басқару процесі) және дұрыс ұйымдастырылған кезде басқа процестермен қатар сапа жүйесі тиімді жұмыс істейді.
Сонымен, валидация мен біліктілік сапа жүйесінің процесі болғандықтан, онымен Ережелердің талаптарына сәйкес әрекет ету керек. Бұл туралы 7 тармақта жазылған: «Сапа жүйесі толығымен құжатталуы керек, оның тиімділігі мониторинг пен талдаудан өтуі керек. Сапа жүйесіне қатысты персоналдың іс-әрекеттері … тиісті жазбаша рәсімдерінде сипатталуы тиіс»
Демек, ұйымда дистрибьютордың процестері мен жабдықтарының валидациясы мен біліктілігін жоспарлау, дайындау және жүргізу тәртібі анықталатын стандартты операциялық процедураны (СОП) әзірлеу және енгізу қажет. СОП-та процесті басқарудың ішкі құралы ретінде қызметкерлердің ұйым, орындау және бақылау бөлігіндегі әрекеттері көрсетілген нәтижеге жеткенге дейін анықталады. Сондықтан СОП әзірлеу дистрибьютордың валидациясы мен біліктілік процесін ұйымдастырудың негізгі кезеңі болып табылады.
СОП-тағы әрекеттерді сипаттау процестің орындаушылары мен оның ұйымдастырушыларына түсінікті болуы үшін сипатталған процесті дәйекті кезеңдерге бөлген дұрыс. 1 суретте сіз осындай топтастырудың мысалын көре аласыз.

1-сурет.
Бұл мақалада біз СОП-та процесті қалай сипаттау керектігін егжей-тегжейлі қарастырмаймыз. Біз бұл тақырыпты СОП әзірлеуге арналған басқа мақалада егжей-тегжейлі ашамыз. Бұл мақалада біз оны тиімді ұйымдастыру мақсатында валидация мен біліктілік процесін сипаттайтын СОП-қа не кіретініне назар аударамыз.
1-суретте көрсетілгендей, сипатталған процесс бірнеше негізгі кезеңдермен бөлінген:
- Біліктілікті және (немесе) валидацияны жоспарлау;
- Біліктілікті және (немесе) валидацияны дайындау және жүргізу;
- Жүргізілген біліктілік және (немесе) валидация нәтижелерін бағалау және рәсімдеу.
Сонымен қатар, схеманың басында сопақ фигура процестің «кірісін» білдіреді, яғни процесті бастау үшін қажет нәрсе – дистрибьютордың процестері, бөлмелері, жүйелері мен жабдықтары. Схеманың соңында процестің «шығуы» белгіленеді, оны жүзеге асыру нәтижесінде ұйым не алады-валидацияланған және білікті процестер, үй-жайлар, жүйелер мен жабдықтар.
1 кезеңді қарастырыңыз - валидация мен біліктілікті жоспарлау.
Бұл кезеңде маңызды және бірінші қадам валидация мен біліктілікке жататын процестер мен жабдықтарды анықтау болып табылады. Бұл талап біз бұрын сілтеме жасаған GDP ережелерінің 50-тармағында көрсетілген: «Ұйым біліктілік пен валидацияға жататын негізгі жабдықтар мен процестерді анықтауы керек…»
Біліктілік пен валидацияны қажет ететін жабдықтар мен процестерді назардан тыс қалдырмау үшін GDP ережелерінің талаптарына назар аудару, тәуекелдерге талдау жүргізу, сондай-ақ Дүниежүзілік денсаулық сақтау ұйымының (ДДҰ) ұсынымдарын ескеру қажет.
GDP ережелерінде, 44-тармақта, дистрибьютордың ең маңызды жабдықтары, яғни дәрілік заттардың сапасын сақтауға әсер етуі мүмкін: «...Ең маңызды жабдыққа кондиционерлер, тоңазытқыш камералар (тоңазытқыштар) немесе құрылғылар, күзет және өрт дабылы, кіруді бақылау жүйелері, желдету жүйесі, ауаны ылғалдандыру және құрғату жүйесі, термогигрометрлер (психрометрлер) немесе температура мен ылғалдылықты тіркеу үшін пайдаланылатын өзге де жабдықтар, сондай-ақ тасымалдау үшін пайдаланылатын жабдықтар жатады.» Жоғарыда аталған барлық жабдықтар тексеруге және калибрлеуге жататын өлшеу құралдарынан басқа біліктілік пен валидацияға жатады. Сондай-ақ, GDP ережелерінің 5-тармағында процестердің қажеттілігі туралы жазылған: «…Көтерме саудада сату процесінің негізгі кезеңдері (аса маңызды өзгерістерді қоса алғанда) негізделуі және қажет болған жағдайда ... валидациялануы тиіс». Ал 44-тармақта. GDP компьютерленген жүйелерді тексеруге қойылатын талаптар: «Компьютерленген жүйені пайдалануды бастамас бұрын, жүйенің берілген нәтижелерді дәл, біркелкі және қайталанатын түрде алуға қабілетті екенін тексеру немесе тексеру арқылы көрсету керек».
ДДҰ ұсынымдарында 9-қосымшада, 7-қосымшада «Температурамен бақыланатын сақтау аймақтарының біліктілігі», 2.2.1-тармақта мыналар көрсетілген: «Термолабильді дәрілік заттарды өңдеу, сақтау және тарату үшін пайдаланылатын температурамен бақыланатын барлық жабдықтар мен жүйелер білікті болуы тиіс».
Біліктілік пен валидацияға жататын процестер мен жабдықтардың тізбесін нақтылау үшін процестер мен пайдаланылатын жабдықтардың дәрілік заттардың сапасын сақтауға әсеріне байланысты тәуекелдерге талдау жүргізу қажет.
Осы тізім негізінде валидация және біліктілік бойынша жұмыстарды жүргізудің жоспар-кестесін жасауға кірісуге болады. Жоспар-кесте, әдетте, біліктілік пен валидация процесін ұйымдастырудың ажырамас бөлігі болып табылады. Ол әдетте келесі ақпаратты қамтиды:
- бұрын жасалған процестер мен жабдықтардың тізбесіне сәйкес біліктілік немесе валидация объектісінің атауы;
- әрбір объект бойынша біліктілік және валидация жөніндегі іс-шараларды өткізу мерзімдері;
- жұмыстарды орындаушылар.
Бұл жерде біліктілік немесе валидация бойынша жұмыстарды орындаушылар дистрибьютордың немесе аутсорсердің осы мәселелерде құзыретті қызметкерлері (мысалы, қоймалық өңдеу немесе тасымалдау аутсорсингке берілген болса), сондай-ақ сыртқы мердігерлік ұйым болуы мүмкін екенін атап өткен жөн.
Біліктілік пен валидация жоспарын нақты біліктілік немесе валидация іс-қимыл жоспарымен және олардың сипаттамасымен шатастырудың қажеті жоқ екенін ескеру маңызды, бұл екі түрлі құжат.
Сондай-ақ, егер біліктілік пен валидация бойынша іс-шараларды мердігер ұйым жүргізетін болса, онда барлық валидациялық құжаттаманы (біліктілік жоспары, әдістемелер, хаттамалар, есептер және т.б.) әдетте осы мердігер ұйым ұсынатынын ескеру қажет. Егер біліктілік пен валидация бойынша іс-шараларды өз бетімен өткізу жоспарланса, барлық валидациялық құжаттаманы дайындауды жоспарлау қажет, ол үшін әдетте арнайы оқытылған қызметкерлер тобы жауап береді.
Жоспарлаудың бірінші кезеңінде жүзеге асырылады:
- біліктілікке және валидацияға жататын процестер мен жабдықтардың тізбесін дайындау;
- біліктілік және валидация жөніндегі іс-шараларды өткізудің жоспар-кестесін әзірлеу;
- біліктілік және валидация жөніндегі іс-шараларды орындаушыларды айқындау.
Осы кезеңді сипаттау кезінде СОП-та барлық іс-әрекеттердің орындалуына жауапты тұлғаларды, құжаттарды келісетін және бекітетін тұлғаларды, сондай-ақ көрсетілген іс-әрекеттердің орындалуын бақылауға жауапты тұлғаларды көрсету қажет.
2-кезең - біліктілікті және (немесе) валидацияны дайындау және өткізу.
Осы кезеңде біліктілік және валидация бойынша іс-шараларды өткізу үшін барлық қажетті әрекеттерді анықтау қажет. СОП-та көрсетілуі тиіс дайындық жұмыстарының және тиісінше іс-қимылдардың көлемі әрбір нақты жағдайда кімнің күшімен (дистрибьютор қызметкерлерімен немесе мердігерлік ұйыммен) біліктілік пен валидация жүргізілетініне байланысты.
Егер жұмыстар өз күшімен жүргізілетін болса, онда СОП-та біліктілік және валидация бойынша жұмыстарды жүргізу әдістемесін әзірлеу кезеңін көздеу қажет. Валидация немесе біліктілік үшін тиімді әдісті қалай жасауға болады - бұл басқа мақаланың тақырыбы. Құжаттаманы, әдістемені әзірлеуге және валидациялық жұмыстарды жүргізуге қатысатын қызметкерлердің осы әрекеттерді орындау үшін жеткілікті құзыреттерге ие болуы маңызды. Біліктілік пен валидацияны жүргізудің барлық әзірленген әдістемелері, сондай-ақ дистрибьютор өз қызметін жүзеге асыру үшін пайдаланатын жабдықтар мен процестер біліктілік және валидация жөніндегі СОП нұсқаулықтарында қоса берілуі немесе сипатталуы мүмкін. Осылайша, сапа жүйесінде реттеуші құжаттаманың қадағалануы қамтамасыз етіледі.
Валидация және біліктілік жөніндегі жұмыстарды орындау үшін мердігер ұйым жалданған жағдайда, мердігер ұйымды бағалау және таңдау жөніндегі іс-шараларды көздеу қажет. Осылайша, қызмет көрсетушілерді бағалау және таңдау процестерінің сапа жүйесіндегі біліктілік пен валидация процесімен өзара әрекеттесуі байқалады. Әдетте, біліктілік және валидация бойынша СОП-та қызмет көрсетушілерді бағалау және таңдау бойынша СОП-қа сілтеме көрсетіледі, оған сәйкес мердігерді бағалаудың нақты критерийлері айқындалады. Әрине, таңдалған мердігер ұйыммен қызмет көрсету туралы келісім-шарт жасасу керек, оны рәсіммен де анықтау керек.
Мердігер ұйым тартылған жағдайда, әдетте барлық құжаттаманы әзірлейді және мердігердің мамандары барлық жұмыстарды дистрибьютор өкілінің бақылауымен жүргізеді. Біліктілік және валидация бойынша жұмыстарды жүргізу тұрақты негізде де, бір реттік негізде де пайдаланылуы мүмкін, мысалы, белгіленген мерзімге жету немесе тәжірибе жинау қажет болғанда.
Айта кету керек, егер мердігер ұйым біліктілік пен валидация жұмыстарын жүргізсе, онда осы процесті ұйымдастыруға жауапты дистрибьютор қызметкерлері мердігер жүргізетін іс-әрекеттердің әдістері мен ерекшеліктерін толық түсініп, түсінуі керек.
Осы кезеңді сипаттау кезінде СОП-та барлық іс-әрекеттердің орындалуына жауапты тұлғаларды, құжаттарды келісетін және бекітетін тұлғаларды, сондай-ақ көрсетілген іс-әрекеттердің орындалуын бақылауға жауапты тұлғаларды көрсету қажет.
3-кезең - өткізілген біліктілік және (немесе) валидация нәтижелерін бағалау және рәсімдеу.
Осы кезеңде жүргізілген біліктілік пен валидация нәтижелерін ресімдеуге байланысты іс-әрекеттер, сондай-ақ егер біліктілік немесе валидация жүргізу кезінде ауытқулар анықталған жағдайда іс-әрекеттер айқындалады.
Егер біліктілік пен валидация өз бетінше жүргізілсе, онда СОП-та нәтижелерді ресімдеу тәртібін анықтау қажет, мысалы, алынған деректерді талдау және қорытындыны рәсімдеу, процесте анықталған жұмыстардың барлық ауытқулары туралы есепті қалыптастыру, қорытындылар мен ұсыныстармен қорытынды есепті рәсімдеу.
Егер біліктілік пен валидацияны мердігер жүргізсе, онда мердігер ұсынған валидациялық құжаттарды қабылдау және тексеру жөніндегі іс-қимылдар көзделсін.
Есептер түрінде деректерді рәсімдеу қажеттілігі туралы 50-тармақта жазылған. GDP: «Валидация немесе біліктілік жүргізу есептермен рәсімделеді, онда алынған нәтижелер жинақталуы, сондай-ақ анықталған ауытқуларға түсініктемелер берілуі тиіс.»
Сондай-ақ, осы кезеңде САРА (ағылшын тілінен Corrective and Preventive Action), әзірлеуді қарастыру қажет, егер ауытқулар анықталса, бұл талаптар 51-тармақта белгіленген. GDP: «Белгіленген рәсімдерден ауытқулар құжатпен рәсімделеді, оларды жоюға, сондай-ақ олардың болашақта пайда болуын болдырмауға бағытталған шаралар әзірленеді (түзету және алдын алу әрекеттері)…». Әдетте, егер біз СОП-тағы әрекеттердің сипаттамасы туралы айтатын болсақ, онда біліктілік пен валидация бойынша СОП-та қызметкерлердің әрекеттері егжей-тегжейлі анықталған СОП САРА сілтемесі көрсетіледі.
САРА іске асырылғаннан кейін, қажет болған жағдайда қанағаттанарлық нәтижелер алынғанға дейін біліктілік немесе валидация бойынша қосымша іс-шаралар жүргізіледі, тиісінше бұл іс-шаралар СОП және жазба нысандарында да көзделуге тиіс. Шотқа қойылатын талаптар бұл 51 тармақта көрсетілген. GDP «…Тиісті қызметкерлер бекітетін процестің немесе жабдықтың сәтті валидациясы мен жарамдылығы туралы дәлелдер алынуы керек.».
Соңында мен біліктілік пен валидация процесін бағалаудың негізгі көрсеткіштерін қоюды ұсынамын, өйткені процестерді СОП-та анықтап, сипаттап қана қоймай, оларды басқару керек. Мұнда әйгілі кәсіпкер Джек Уэлчтің сөздерін келтірген жөн: «Өлшеуге болмайтын нәрсені басқару мүмкін емес.». Дистрибьютордың біліктілігі мен валидация процесін бағалау көрсеткіштері келесі аспектілерді қамтуы мүмкін:
- Біліктілікті және/немесе валидацияны уақтылы жүргізу.
- Біліктілік және/немесе валидация бойынша есептердің болуы және толықтығы.
- Біліктілік және/немесе валидация нәтижелері бойынша ауытқуларға уақтылы ден қою.
Осы көрсеткіштер анықталғаннан кейін оларды күндер, сағаттар, оқиғалар саны, қаржылық шығындар және әр көрсеткішке сәйкес келетін басқа параметрлер сияқты жоспарлы мәндерді белгілеу арқылы сандық бағалау қажет. Өлшенетін көрсеткіштерді анықтау GDP тұрғысынан маңызды аспект болып табылады. GDP 13-тармағында көрсетілген басшылық тарапынан талдау процесіне қойылатын талаптарда айтылады: «Ұйым басшылығы сапа жүйесін мерзімді шолудың рәсімделген процесін белгілеуі керек. Шолу мыналарды қамтуы керек: … б) талаптардың саны, белгіленген нормалардан ауытқулар, түзету және ескерту әрекеттерінің тиімділігі, процестердегі өзгерістер, аутсорсинг қызметі туралы пікірлер, өзін-өзі тексеру процестері (тәуекелдерді талдау мен аудиттерді қоса алғанда), сыртқы бақылау нәтижелері (инспекциялар мен аудиттерді қоса алғанда)сияқты сапа жүйесінің процестерінің тиімділігін бақылау үшін пайдаланылуы мүмкін тиімділік көрсеткіштерін бағалау, анықталған сәйкессіздіктер, клиенттердің аудиттері;...».
Осы мақаладағы ақпарат пайдалы болады және фармацевтикалық өнім дистрибьюторларында сапа жүйесінде біліктілік пен валидация процесін тиімді ұйымдастыруға көмектеседі деп шын жүректен үміттенеміз.
Егер сізде сұрақтар туындаса немесе кез-келген нәрсені егжей-тегжейлі талқылағыңыз келсе, бізге
 Алексей Хилюк
Алексей Хилюк
GDPЖол жобасының қатысушысы
Дереккөз: https://gdpway.com/validarticle

Алексей Хилюк, участник проекта GDPПуть
Эта статья основана на практическом опыте работы. В связи с этим, хочу выразить благодарность действующим консультантам проекта GDPПуть из Казахстана, Узбекистана и России за участие в написании статьи, предоставление информации о методиках, отзывов клиентов, а также за внимание к важности и необходимости освещения данной темы.
В данной статье мы разберем не методики валидации или какие-то конкретные примеры проведения работ по валидации и квалификации, а то, как в соответствии с нормативными требованиями организовать процесс валидации и квалификации в рамках системы качества дистрибьютора.
Поскольку процесс валидации и квалификации является обязательным процессом системы качества дистрибьютора согласно требованию GDP (Good distribution practice), то прежде всего необходимо обратить внимание на определения и требования, указанные в правилах GDP.
В настоящей статье мы взяли за основу требования Правил надлежащей дистрибьюторской практики, утвержденных решением от 3 ноября 2016 года № 80 Советом Евразийской экономической комиссии.
Для начала давайте рассмотрим определения терминов валидация и квалификация Правилах GDP:
- «валидация» - документально оформленные действия, доказывающие, что процедура, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование будет постоянно приводить к результатам, соответствующим заранее установленным критериям приемлемости;
- «квалификация» - документально оформленные действия, удостоверяющие и подтверждающие, что оборудование или вспомогательные системы смонтированы должным образом, правильно функционируют и действительно приводят к ожидаемым результатам.
Теперь обратим внимание на то, что написано в пункте 50 Правил GDP: «Организация должна определить ключевое оборудование и процессы, которые подлежат квалификации и (или) валидации с целью подтверждения надлежащего монтажа и эксплуатации. Объем проводимых работ по квалификации и (или) валидации (например, хранение, подготовка к отгрузке и упаковка) определяется на основе документально оформленного анализа рисков».
Из этого требования становится ясно, что валидация и квалификация - это не просто документально оформленные тесты, подтверждающие, что какой-либо процесс или оборудование соответствуют заданным требованиям или должным образом функционируют. Валидация и квалификация - это необходимый процесс системы качества дистрибьютора, связанный с другими процессами (например, процессом управления рисками), и при правильной организации которого, наряду с другими процессами, система качества будет функционировать эффективно.
Итак, раз валидация и квалификация - это процесс системы качества, то следует поступать с ним в соответствии с требованиями Правил. Об этом написано в пункте 7: «Система качества должна быть полностью документирована, ее эффективность должна подвергаться мониторингу и анализу. Действия персонала, относящиеся к системе качества, должны быть описаны в соответствующих письменных процедурах…»
Следовательно, в организации необходимо разработать и внедрить в работу стандартную операционную процедуру (СОП), в которой будет определен порядок планирования, подготовки и проведения валидации и квалификации процессов и оборудования дистрибьютора. Именно в СОП, как внутреннем инструменте управления процессом, определяются действия сотрудников в части организации, исполнения и контроля до получения заданного результата. Поэтому разработка СОП является основополагающим этапом в организации процесса валидации и квалификации дистрибьютора.
Для того чтобы описание действий в СОП было понятно исполнителям процесса и его организаторам, описываемый процесс лучше разбить на последовательные этапы. На рисунке 1 вы можете видеть пример такой разбивки.

Рис. 1. Пример разбивки описания действий в СОП.
В данной статье мы не будем детально разбирать, как описывать процесс в СОП. Эту тему мы подробно раскроем в другой статье, посвящённой разработке СОП. В данной статье мы обратим внимание на то, что должно быть включено в СОП, описывающую процесс валидации и квалификации, с целью его эффективной организации.
Как видно на рисунке 1, описываемый процесс разделен нескольких основных этапов:
1) Планирование квалификации и (или) валидации;
2) Подготовка и проведение квалификации и (или) валидации;
3) Оценка и оформление результатов проведенной квалификации и (или) валидации.
При этом в начале схемы овальной фигурой обозначен «вход» процесса, то есть то, что необходимо для начала процесса – это процессы, помещения, системы и оборудование дистрибьютора. В конце схемы обозначен «выход» процесса, то, что организация получает в результате его реализации – валидированные и квалифицированные процессы, помещения, системы и оборудование.
Рассмотрим 1-й этап - планирование валидации и квалификации.
На этом этапе важным и первым шагом является определение процессов и оборудования, подлежащих валидации и квалификации. Это требование указано в пункте 50 Правил GDP, на который мы уже ссылались ранее: «Организация должна определить ключевое оборудование и процессы, которые подлежат квалификации и валидации…».
Для того чтобы не упустить из виду оборудование и процессы, требующие квалификации и валидации, необходимо обратить внимание на требования Правил GDP, провести анализ рисков, а также учесть рекомендации Всемирной организации здравоохранения (ВОЗ).
В Правилах GDP, в пункте 44, перечислено наиболее значимое оборудование дистрибьютора, то есть то, которое может оказывать влияние на сохранение качества лекарственных средств: «…К наиболее значимому оборудованию относятся кондиционеры, холодильные камеры (холодильники) или устройства, охранная и пожарная сигнализация, системы контроля доступа, вентиляционная система, система увлажнения и осушения воздуха, термогигрометры (психрометры) или иное оборудование, используемое для регистрации температуры и влажности, а также оборудование, используемое для транспортировки». Все вышеперечисленное оборудование подлежит квалификации и валидации, кроме средств измерений, которые подлежат поверке и калибровке. Также в пункте 5 Правил GDP, написано о необходимости процессов: «…Ключевые этапы процесса оптовой реализации (включая наиболее значимые изменения) должны быть обоснованы и при необходимости валидированы…». А в пункте 44. GDP установлены требования к валидации компьютеризированных систем: «Перед началом использования компьютеризированной системы необходимо продемонстрировать с помощью валидации или верификации, что система способна получать заданные результаты точно, единообразно и воспроизводимо».
В Рекомендациях ВОЗ в приложении 9, дополнении 7 «Квалификация зон хранения с контролируемой температурой», в пункте 2.2.1 указано следующее: «Все оборудование и системы с контролируемой температурой, используемые для обработки, хранения и распределения термолабильных лекарственных средств должны быть квалифицированы».
Необходимо провести анализ рисков, связанных с влиянием процессов и используемого оборудования на сохранение качества лекарственных средств, чтобы уточнить перечень процессов и оборудования, подлежащих квалификации и валидации.
На основании этого перечня можно приступать к составлению плана-графика проведения работ по валидации и квалификации. План-график, как правило, является неотъемлемой составляющей организации процесса квалификации и валидации. Он обычно содержит следующую информацию:
- наименование объекта квалификации или валидации согласно ранее составленному перечню процессов и оборудования;
- сроки проведения мероприятий по квалификации и валидации по каждому объекту;
- исполнителей работ.
Здесь стоит отметить, что исполнителями работ по квалификации или валидации могут быть как компетентные в этих вопросах сотрудники дистрибьютора или аутсорсера (например, если складская обработка или транспортировка переданы на аутсорсинг), так и внешняя подрядная организация.
Важно отметить, что не нужно путать план-график проведения квалификации и валидации с планом конкретных действий по квалификации или валидации и их описанием, это два разных документа.
Следует также учитывать, что если мероприятия по квалификации и валидации будут проводиться подрядной организацией, то всю валидационную документацию (план квалификации, методики, протоколы, отчёты и пр.) обычно предоставляет эта подрядная организация. Если же мероприятия по квалификации и валидации планируется проводить своими силами, необходимо запланировать подготовку всей валидационной документации, за что обычно отвечает специально обученная группа сотрудников.
На первом этапе планирования осуществляется:
- подготовка перечня процессов и оборудования, подлежащих квалификации и валидации;
- разработка плана-графика проведения мероприятий по квалификации и валидации;
- определение исполнителей мероприятий по квалификации и валидации.
При описании этого этапа в СОП необходимо указать ответственных лиц за исполнение всех действий, лиц, согласующих и утверждающих документы, а также лиц, ответственных за контроль исполнения указанных действий.
2-й этап - подготовка и проведение квалификации и (или) валидации.
На данном этапе необходимо определить все необходимые действия для проведения мероприятий по квалификации и валидации. Объем подготовительных работ и, соответственно, действий, которые необходимо указать в СОП, зависит от того, чьими силами (сотрудниками дистрибьютора или подрядной организацией) будет проводиться квалификация и валидация в каждом конкретном случае.
Если работы будут проводиться собственными силами, то в СОП необходимо предусмотреть этап разработки методики проведения работ по квалификации и валидации. Как разработать эффективную методику для проведения валидации или квалификации – это тема уже другой статьи. Важно, чтобы сотрудники, участвующие в разработке документации, методики и проведении валидационных работ, обладали достаточными компетенциями для выполнения этих действий. Все разработанные методики проведения квалификации и валидации, а также оборудования и процессов, используемых дистрибьютором для осуществления своей деятельности, могут быть приложены или описаны в инструкциях к СОП по квалификации и валидации. Таким образом, будет обеспечена прослеживаемость регламентирующей документации в системе качества.
В случае, когда нанимается подрядная организация для выполнения работ по валидации и квалификации, необходимо предусмотреть мероприятия по оценке и выбору подрядной организации. Таким образом, прослеживается взаимодействие процессов оценки и выбора поставщиков услуг с процессом квалификации и валидации в системе качества. Как правило, в СОП по квалификации и валидации указывается ссылка на СОП по оценке и выбору поставщиков услуг, в соответствии с которым определяются четкие критерии оценки подрядчика. И, конечно, с выбранной подрядной организацией необходимо заключить договор на оказание услуг, что тоже должно быть определено процедурой.
В случае привлечения подрядной организации, обычно разрабатывают всю документацию и проводят все работы специалисты подрядчика под наблюдением представителя дистрибьютора. Проведение работ по квалификации и валидации может использоваться как на постоянной основе, так и разово, например, когда необходимо уложиться в установленные сроки или набраться опыта.
Следует отметить, что если работы по квалификации и валидации проводит подрядная организация, то сотрудникам дистрибьютора, отвечающим за организацию данного процесса, необходимо в полной мере понять и разобраться в методиках и специфике проводимых действий подрядчиком.
При описании этого этапа в СОП необходимо указать ответственных лиц за исполнение всех действий, лиц, согласующих и утверждающих документы, а также лиц, ответственных за контроль исполнения указанных действий.
3-й этап - оценка и оформление результатов проведенной квалификации и (или) валидации.
На данном этапе определятся действия, связанные с оформлением результатов проведенной квалификации и валидации, а также действия, в случае если при проведении квалификации или валидации были выявлены отклонения.
Если квалификация и валидация проводится своими силами, то в СОП необходимо определить порядок оформления результатов, например, анализ полученных данных и оформление заключения, формирование отчета о всех отклонениях выявленных в процессе проводимых работ, оформление итогового отчета с выводами и рекомендациями.
Если квалификация и валидация проводится подрядчиком, то предусмотреть действия по принятию и проверки валидационных документов, предоставленных подрядчиком.
О необходимости оформления данных в виде отчетов написано в пункте 50. GDP: «Проведение валидации или квалификации оформляется отчетами, в которых должны быть обобщены полученные результаты, а также даны объяснения выявленным отклонениям».
Также на этом этапе нужно предусмотреть разработку корректирующих и предупреждающих действий САРА (от англ. Corrective and Preventive Action), если были выявлены отклонения, эти требования установлены в пункте 51. GDP: «Отклонения от установленных процедур документально оформляются, разрабатываются меры, направленные на их устранение, а также на предотвращение их появления в будущем (корректирующие и предупреждающие действия)…». Как правило, если говорить об описании действий в СОП, то в СОП по квалификации и валидации указывается ссылка на СОП САРА, в котором подробно определены действия сотрудников.
После реализации САРА, проводятся при необходимости дополнительные мероприятия по квалификации или валидации до тех пор, пока не будут получены удовлетворительные результаты, соответственно эти действия также должны быть предусмотрены в СОП и формах для записей. Требования на счет этого указаны в п 51 GDP «…Должны быть получены доказательства успешной валидации и приемлемости процесса или оборудования, которые утверждаются соответствующими работниками».
В завершении рекомендую уставить ключевые показатели оценки процесса квалификации и валидации, потому как процессы необходимо не только определить и описать в СОП, но ими нужно еще и управлять. Здесь будет уместно примести слова известного предпринимателя Джека Уэлча: «Что невозможно измерить, тем невозможно управлять». Показатели оценки процесса квалификации и валидации дистрибьютора могут включать следующие аспекты:
- Своевременность проведения квалификации и/или валидации.
- Наличие и полнота отчетов по квалификации и/или валидации.
- Своевременное реагирование на отклонения по результатам квалификации и/или валидации.
После определения этих показателей их необходимо количественно оценить, установив плановые значения, такие как дни, часы, количество инцидентов, финансовые затраты и другие параметры, соответствующие каждому показателю. Определение измеримых показателей является важным аспектом с точки зрения GDP. В требованиях к процессу анализа со стороны руководства, указанных в пункте 13 GDP, говорится: «Руководство организации должно установить формализованный процесс периодического обзора системы качества. Обзор должен включать в себя: … б) оценку показателей эффективности, которые могут быть использованы для мониторинга эффективности таких процессов системы качества, как количество претензий, отклонений от установленных норм, эффективность корректирующих и предупреждающих действий, изменения в процессах, отзывы о деятельности по аутсорсингу, процессы самопроверки (включая анализ рисков и аудиты), результаты внешнего контроля (включая инспекции и аудиты), выявленные несоответствия, аудиты клиентов...».
Искренне надеемся, что информация в этой статье будет полезна и поможет более эффективно организовать процесс квалификации и валидации в системе качества у дистрибьюторов фармацевтической продукции.
Если у вас возникнут вопросы или вы захотите обсудить что-либо более детально, пожалуйста, не стесняйтесь связаться с нами по электронной почте:
 Алексей Хилюк
Алексей Хилюк
Участник проекта GDPПуть
Источник : https://gdpway.com/validarticle.

22-23 октября 2024 года в Астане состоится IV Международный фармацевтический форум «Global Pharm» и IV Международный форум по медицинской технике «MedTech».
Мероприятие организовывается общественным фондом «Silk way development fund» при поддержке Правительства РК и Министерства здравоохранения.
Форумы «Global Pharm» и «MedTech» станут платформами для обмена опытом, налаживания партнерских связей и обсуждения новых возможностей для сотрудничества. Ожидается участие более 300 оффлайн и более 2000 онлайн делегатов из разных стран, что делает это событие важной вехой для укрепления сотрудничества в области здравоохранения.
Главная цель – способствовать привлечению государственных и частных инвестиций в развитие фармацевтического производства в Казахстане, наращивание научного и кадрового потенциалов, увеличение экспорта отечественной фармацевтической продукции, а также оснащение качественной и современной медицинской техникой организаций здравоохранения страны.
Среди спикеров – представители Министерства здравоохранения РК, ТОО «СК-Фармация», Комитета медицинского и фармацевтического контроля МЗ РК, Национального центра экспертизы лекарственных средств и медицинских изделий, а также общественные медицинские организации и сообщества, международные фармацевтические компании BigPharma, отечественные фармпредприятия и других стран СНГ.
Один из ключевых моментов – онлайн круглый стол с участием Министерства здравоохранения РК и представителей иностранных компании – мировых производителей, таких как Johnson&Johnson, Biocad, Takeda, Novartis, Nobel, Santo, Stada.
Мероприятие пройдет в г.Астана в Школе медицины Назарбаев Университета (улица Керей-Жанибек хандар 5/1), онлайн – на интеллектуальной платформе E-forum.net.

Этот вопрос сегодня волнует всех участников сферы обращения лекарственных средств и ответ на него предоставил и. о. руководителя управления фармацевтической экспертизы департамента экспертизы лекарственных средств РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Даулет Шамратович БАЛМАГАМБЕТОВ в рамках Международной практической конференции «Единый рынок лекарственных средств ЕАЭС», проводимой 17-18 октября 2024 года компанией BRAVO BUSINESS FORUMS.
Спикер отметил, что регистрационные удостоверения (РУ), выданные по национальной процедуре, остаются действующими только до 31 декабря 2025 года. Исключение составляют стратегически важные лекарственные средства. Их регистрационные удостоверения выдаются по национальной процедуре, но остаются действующими и после этой даты. Однако обращение таких препаратов возможно только в случае чрезвычайных условий.
Напомним, что в соответствии с законодательством, к таким условиям относятся:
- военные действия и ликвидация их последствий;
- возникновение, предупреждение и ликвидация последствий чрезвычайных ситуаций;
- угроза возникновения, распространения новых особо опасных инфекционных заболеваний и ликвидация их последствий;
- профилактика, диагностика, лечение заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, а также ликвидация их последствий;
- отсутствие или угроза отсутствия лекарственных средств или медицинских изделий на рынках государств-членов Евразийского экономического союза в условиях введения ограничительных экономических мер в отношении хотя бы одного из государств-членов.
В ходе конференции обсуждаются основные изменения в правилах регистрации и экспертизы лекарственных препаратов в ЕАЭС, рассматриваются проблемы технического взаимодействия в государствах признания, основные ошибки при подготовке регистрационного досье в соответствии с правилами ЕАЭС и другие вопросы. С докладами выступают ведущие специалисты экспертных органов в области обращения лекарственных средств и медицинских изделий стран ЕАЭС. Они отвечают на все вопросы участников конференции.

Ауаның ластануы бүкіл әлемдегі қалалық агломерациялар мен өнеркәсіптік аудандардағы адамдардың денсаулығына теріс әсер етеді. Нәтижесінде респираторлық аурулардың саны үнемі өсіп келеді, сонымен бірге тиісті дәрі-дәрмектерге сұраныс артып келеді.
«Harro Höfliger» зертханалық жағдайда да ингаляторларды өндіруге және сынақ партияларын жасауға, сондай-ақ өнеркәсіптік өндіріске арналған автоматтандырылған технологияларды ұсынады. Ұнтақты ингаляторларын (DPI) толтыру үшін «Harro Höfliger» тамаша мөлшерлеу технологиясын, сондай-ақ ультра жұқа дисперсті «жұмсақ» аэрозольді ингаляторларды құрастырудың «know-how» ұсынады. Өндіріс процесі блистермен, капсулалармен, дискілермен, резервуарлармен, ұнтақ пен сұйық өніммен толтырылған картридждермен жұмыс істеуге мүмкіндік береді.
 «Harro Höfliger» - ингаляторлардың барлық түрлеріне арналған шешімдер
«Harro Höfliger» - ингаляторлардың барлық түрлеріне арналған шешімдер
Жобаның барлық кезеңдерінде «Harro Höfliger» компаниясының сарапшыларының қолдауы-бұл тапсырыс берушілер үшін қосымша артықшылықтар, атап айтқанда:
- Әзірлеуден бастап өнімді нарыққа шығаруға дейінгі қысқа уақыт;
- Өндірісті масштабтаудың кең мүмкіндіктері;
- Әр түрлі контейнерлерге аса дәл микромөлшерлеу;
- Өнімнің ерекшеліктерін ескере отырып оңтайландырылған толтыру технологиялары;
- IPC тексерулерімен расталған сенімділіктің жоғары деңгейі;
- Ингаляторларды толтырудан қаптауға дейінгі бір өндірістік тізбек;
- Таза үй-жайлар жағдайында белсенді өнімде тестілеу.
Микромөлшерлеу
«Harro Höfliger» ингаляциялық өнімдерді микродозалаудың әртүрлі технологияларын ұсынады, әсіресе ұнтақ ингаляторлары (DPI) үшін. Бұл технологиялар сусымалы және когезиялық ұнтақтарды, тіпті 1 мг-нан аз мөлшерлеуде де сенімді толтыруды қамтамасыз етеді.
Сызықтық бақылау жүйелері
Классикалық салмақты басқарудан басқа, «Harro Höfliger» рентгенографиялық жүйелер мен жетілдірілген салмақты бақылау (AMV) датчиктерін қолдана отырып, дозаны бақылау технологиясын ұсынады. Осы инновациялық технологиялардың арқасында тұтынушылар тиімді өндіріске және белсенді ингредиенттердің 100% салмақтық сызықтық бақылауына ие болады. Камера жүйелері барлық өндірістік процестердің сенімді мониторингін қамтамасыз етеді.
Сонымен қатар, «Harro Höfliger» - бұл ұнтақты ингаляциялау технологиясы, орама материалдарын өңдеу (трансдермальды пластырлер, арнайы мақсаттағы пластырлер, нәжіс қабылдағыштар, инфузиялық пакеттер), ұнтақты ингаляторлар, автоинъекторлар, бірнеше компоненттермен жұмыс істеу, қаптама (воллеттерге/блистерлік карталарға блистерлер, көлденең картонажды машиналар) сияқты медициналық өнімдерді жинаудың толық циклі.
«Фарма Унион» ЖШҚ - Ресей мен ТМД-дағы «Harro Höfliger» ресми өкілдігі.
www.hoefliger.com–да көбірек ақпарат
«Harro Höfliger» мамандарының байланыс деректері:
|
Ресей Федерациясында: |
Германияда: |
|
Александр Харитонов |
Alex Bruev |
|
Тікелей желі: +7 495 105 91 21 |
Тікелей желі: +49 7191 501-1617 |
|
Ұялы телефон нөмірі: +7 916 934 94 56 |
Ұялы телефон нөмірі:+49 152 56898590 |
«Өзбекстан және Орталық Азия Фармасы» Конгресі мен көрмесі» (2024 жылғы 29-30 қазан, Ташкент, Өзбекстан) №12 стендімізге келуге шақырамыз.
Программа автоматизации для аптек Казахстана
Новости

В США обновлены клинические рекомендации по первичной профилактике инсульта
Американской кардиологической ассоциацией и Американской ассоциацией по бор...

Министры здравоохранения Казахстана и Кыргызстана подписали план сотрудничества
29 октября 2024 года на полях 74-й сессии Европейского регионального комите...

МЗ РК расширит перечень и объем лекарств, закупаемых через ЮНИСЕФ
В ходе посещения Министром здравоохранения РК закупочного центра ЮНИСЕФ в г...

ВОЗ: вакцины играют ключевую роль в снижении устойчивости к антибиотикам
Всемирной организацией здравоохранения (ВОЗ) опубликован доклад, где подчер...

КМФК МЗ РК напомнил о необходимости соблюдать правила маркировки лекарств
Департамент Комитета медицинского и фармацевтического контроля Министерства...

В ЕАЭС утверждены методические рекомендации по классификации МИ для диагностики in vitro
Рекомендацией Коллегии Евразийской экономической комиссии от 23 сентября 20...

FDA одобрен новый препарат для лечения инфекций мочевыводящих путей
Управлением США по контролю за качеством пищевых продуктов и лекарственных ...

В РК будет снято ограничение на госпитализацию больных с ОРВИ в возрасте от 15 до 64 лет
Министерством здравоохранения Республики Казахстан разработан проект приказ...
FDA одобрено портативное устройство для лечения немелкоклеточного рака легких
Управлением США по контролю за качеством пищевых продуктов и лекарственных ...
Статьи
Тимур Муратов назначен вице-министром здравоохранения Республики Казахстан
Постановлением Правительства Республики Казахстан Муратов Тимур Муратович назначен на должность вице-мини�

Постановлением Правительства Республики Казахстан Муратов Тимур Муратович назначен на должность вице-министра здравоохранения. Об этом сообщает пресс-служба Правительства.
Родился в 1977 году в области Абай. Окончил Семипалатинскую государственную медицинскую Академию, Евразийский гуманитарный институт, Казахстанский медицинский университет «ВШОЗ».
Трудовую деятельность начал в 2001 году врачом-урологом в поликлинике №6 города Астаны.
В разные годы работал в оздоровительном центре «Ақ ниет», Главной военной поликлинике Министерства обороны, Национальном научном медицинском центре.
В 2010-2015 гг. – заведующий отделением, заместитель главного врача городской больницы №2 г. Астаны.
2015-2017 гг. – главный врач Акмолинской областной больницы №2.
2017-2018 гг. – заместитель руководителя Управления здравоохранения г. Астаны.
2018-2019 гг. – главный врач Станции скорой медицинской помощи г. Астаны.
В 2019-2020 гг. был первым заместителем Больницы Медицинского центра Управления делами Президента.
С 2020 по 2023 гг. – руководитель Управления общественного здравоохранения г. Астаны.
С 2023 г. по настоящее время – председатель Правления Национального координационного центра экстренной медицины МЗ РК.
Фото: Официальный интернет-ресурс Правительства Республики Казахстан.
Источник: Официальный интернет-ресурс Правительства Республики Казахстан.
ЗУРИЯДДА САКИПОВА - авторитетный ученый и талантливый педагог! С ЮБИЛЕЕМ!!!
29 октября 2024 года свой юбилей отмечает Сакипова Зуриядда Бектемировна, доктор фармацевтических наук, профес�

29 октября 2024 года свой юбилей отмечает Сакипова Зуриядда Бектемировна, доктор фармацевтических наук, профессор, декан Школы фармации Казахского национального медицинского университета имени С.Д. Асфендиярова, отличник здравоохранения Республики Казахстан.
Профессор Сакипова З.Б. является выдающимся талантливым ученым и педагогом. Она внесла большой вклад в подготовку квалифицированных фармацевтических научных кадров и развитие отечественной фармацевтической науки и практики.
Зуриядда Бектемировна - член Экспертного Совета Национального центра экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники Минздрава РК, участник международных совещаний Фармакопей Мира (International meeting of World Pharmacopoeias, World Health Organization: Geneva, Delhi, Baltimore, Xi’an), член Фармакопейного комитета Евразийского экономического союза, участник международной деятельности по созданию Фармакопейного индекса, участник сессий Европейской Фармакопейной Комиссии, отличник здравоохранения РК, Лауреат Международной премии GUSI 2015. Обладатель международного научного гранта NAWA. Член Фитохимического общества Азии.
Сакипова З.Б. окончила с отличием Павлодарское медицинское училище по специальности фармацевт (1980-83 гг.), а затем, поступила на факультет фармации Алма-Атинского государственного медицинского института (ныне Казахский национальный медицинский университет им. С.Д. Асфендиярова (КазНМУ, Алматы). После продолжила образование в качестве стажера-исследователя (1988-1996) и окончила аспирантуру в 1999 году. В 2000 году защитила диссертацию на соискание ученой степени кандидата фармацевтических наук, а в 2010 году – диссертацию на соискание ученой степени доктора фармацевтических наук.
Зуриядда Бектемировна более 25 лет работает в Казахском национальном медицинском университете имени С.Д. Асфендиярова. С 2011 года она руководила кафедрой технологии лекарств. С 2016 года стала деканом Школы Фармации. Своим трудом она вносит большой вклад в подготовку, переподготовку квалифицированных кадров для здравоохранения, фармации. Велика ее роль и в подготовке научных кадров: докторантов и магистрантов научно-педагогического и профильного направления специальностей «Фармация» и «Технология фармацевтического производства».
Под руководством Сакиповой З.Б. реализовано более 5 научных проектов и опубликовано более 200 научных и учебно-методических трудов, в том числе 17 статей в международных рецензируемых научных журналах информационной базы компании Thomson Reuters и Scopus. Является обладателем более 35 патентов в области разработки лекарственных средств, из них внедрено в производство – 14. Подготовила 7 докторантов и 25 магистрантов.
Одним из важных направлений педагогической деятельности Сакиповой З.Б. является создание и внедрение в учебный процесс программ по современным надлежащим фармацевтическим практикам, фармкосметологии путем организации совместных тренингов, лекций и семинаров ведущими профессионалами этой области.
В 2015 году Сакипова З.Д была удостоена высокой награды - Премии Мира GUSI (азиатский аналог Нобелевской премии). Впервые в истории нашей страны эта награда была вручена ученому из Казахстана. Премия была вручена за научные достижения, выдающиеся результаты в области фундаментальных и прикладных исследований фармации и медицины Казахстана, в целях улучшения жизни людей и поиска оригинальных разработок лекарственных препаратов во имя благосостояния и здоровья народа, за подготовку докторантов и магистрантов в рамках совместных международных научных исследований, а также сотрудничество с ведущими университетами мира.
Профессор Сакипова З.Б. активно участвует в развитии фармацевтической науки в РК путем расширения международного сотрудничества и обмена опытом с ведущими международными высшими учебными заведениями России, Украины, Ирландии, Польши, Чехии, Словакии, Китая и США.
Международное сотрудничество – важный компонент деятельности высших учебных заведений. Оно демонстрирует работу университета и задает стандарты мировых лидеров по изучению передовых тенденций и новых знаний, без которых невозможно представить современное образование.
Школа фармации КазНМУ им. С.Д. Асфендиярова - ведущая фармацевтическая школа Казахстана с богатой историей и научными традициями, занимающимся подготовкой конкурентоспособных профессионалов фармацевтической отрасли. Школа фармации имеет партнерские связи с ведущими университетами и научными центрами СНГ, Европы и Америки. Более 60 ведущих зарубежных ученых работали в период с 2011 года в рамках программы «Визитинг-профессор».
Успешно развивается сотрудничество Школы Фармации КазНМУ имени С.Д. Асфендиярова с ВУЗами-партнерами: Санкт-Петербургским государственным химико-фармацевтическим университетом (Россия); Литовским университетом наук о здоровье, г. Kaунас; Trinity College, Дублин (Ирландия); University of Mississippi, г. Оксфорд (США); University of Brighton, г. Брайтон (Великобритания); Medical University, г. Гданьск (Польша); Национальным фармацевтическим университетом, г. Харьков (Украина); Medical University, г. Люблин (Польша); University of Ljubljana, г. Любляна (Словения); High School of Informatics and Management, г. Жешув (Польша); Faculty of Pharmacy of Comenius University in Bratislava, г. Братислава, Словакия.
В 2011-2015 гг. Сакипова З.Б. участвовала в реализации проекта Министерства здравоохранения и социального развития РК по созданию Государственной фармакопеи Республики Казахстан.
Помимо научно-педагогической деятельности Сакипова З.Б. проводит оценку качества и безопасности лекарственных средств, при их государственной регистрации, в качестве эксперта департамента специализированной экспертизы лекарственных средств при Национальном центре экспертизы ЛС, ИМН и МТ МЗСР РК. Сакипова З.Б. является экспертом независимой организации по оценке качества образования высших учебных заведений по направлению «Фармация - Здравоохранение и социальное обеспечение».
Сакипова З.Б. приняла участие в более чем сорока тренингах, семинарах и лекциях, организованных ведущими компаниями Казахстана, России, Украины, Фармакопейной Конвенцией США, иностранными и отечественными фармацевтическими компаниями.
Зуриядда Бектемировна является победителем проекта Программы международного академического партнерства (NAWA) - Title of the Project: Cosmetic Valley – International Scientific and Implementation Cooperation at the Cosmetology Department от Национального агентства обмена знаниями (Польша).
С днем рождения, Вас, уважаемая Зуриядда Бектемировна!
Коллеги, ученики, медицинская и фармацевтическая общественность, зарубежные партнеры поздравляют Вас с юбилеем. Пусть сбываются мечты, умножаются возможности, успешно идут все дела, хватает сил и энергии для новых свершений! Чтобы в жизни было много смеха и успеха, много радости и счастья, много хороших людей и возможностей для исполнения мечты. Чтобы близкие ценили, коллеги уважали, друзья поддерживали. Благодарных и толковых учеников, новых проектов и коллабораций. Крепкого, могучего здоровья, позитивного настроения, веры в себя и в успех! Пусть благополучие и достаток будут в вашем доме. Здоровья и всех благ родным и близким.
Редакция издания «Фармацевтическое обозрение Казахстана» присоединяется к поздравлениям и от всей души желает Вам, Зуриядда Бектемировна здоровья и процветания!
Накануне Дня Республики Казахстан лучшие деятели здравоохранения удостоены высоких наград
Накануне Дня Республики Казахстан Указом Президента Касым-Жомарта Токаева за значительный вклад в социальн�

Накануне Дня Республики Казахстан Указом Президента Касым-Жомарта Токаева за значительный вклад в социально-экономическое и культурно-духовное развитие страны, укрепление дружбы и сотрудничества между народами, активную общественную деятельность ряд граждан отмечен государственными наградами. В числе награжденных - видные деятели здравоохранения, внесшие значительный вклад в спасение жизни людей и развитие отечественной медицины.
Впервые в истории Независимого Казахстана по инициативе Главы государства за выдающиеся достижения и особые заслуги перед РК в области здравоохранения трем докторам страны присвоены звания «Қазақстанның еңбек сіңірген дәрігері» («Заслуженный врач Республики Казахстан»).
«Почетное звание «Қазақстанның еңбек сіңірген дәрігері», установленное в этом году, присуждено генеральному директору АО «Национальный научный медицинский центр» Абаю Кабатаевичу Байгенжину, руководителю Центра гематологии ТОО «Национальный научный онкологический центр» Вадиму Матвеевичу Кемайкину, врачу КГП «Областная клиническая больница» Карагандинской области Борису Валентиновичу Цхаю.
Орденом «Барыс» І степени награжден Локшин Вячеслав Нотанович – руководитель Международного центра клинической репродуктологии «PERSONA».
Орденом «Парасат» награждены
- Абдикалиулы Нурлан – руководитель отдела АО «Научно-исследовательский институт кардиологии и внутренних болезней»,
- Султаналиев Токан – главный консультант Центра многопрофильной хирургии ТОО «Национальный научный онкологический центр».
Орденом «Құрмет» награждены:
- Байдурин Серик Амангельдиевич – заведующий кафедрой НАО «Медицинский университет Астана»;
- Жумабаева Алтын Зурашевна – директор по сестринскому делу АО «Национальный центр нейрохирургии»;
- Жусупов Болатбек Зиябекович – профессор НАО «Медицинский университет Астана»;
- Кайдаров Бакыт Касенович – профессор НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова»;
- Куренова Гульнара Байбосыновна – и.о. заместителя директора по лечебной работе КГП на ПХВ «Городской перинатальный центр № 2» Управления общественного здоровья города Алматы;
- Оспанова Кульжами Есимхановна – профессор кафедры патологической анатомии НАО «Медицинский университет Астана».
От имени Главы государства государственные награды отличившимся работникам системы здравоохранения вручила заместитель Премьер-Министра РК Тамара Дуйсенова в ходе торжественного мероприятия «Мәңгі жаса, қыран елім – Қазақстаным», посвященное чествованию врачей, деятелей общественного здравоохранения, менеджеров отрасли.
Выступая на торжественном мероприятии, Тамара Дуйсенова подчеркнула значительные достижения, которых Казахстан достиг в сфере здравоохранения за последние годы.
«Отечественная система здравоохранения неуклонно развивается. По поручению Главы государства реализуется Национальный проект, направленный на повышение доступности медицинской помощи для сельских жителей. В рамках программы ведется строительство медицинских пунктов и врачебных амбулаторий. Это позволит улучшить доступность качественной медицинской помощи для населения», — отметила вице-премьер.
Тамара Дуйсенова также подчеркнула, что сегодня оказываются высокотехнологичные медицинские услуги. Среди них – уникальные операции на сердце, выполняемые в Национальном кардиохирургическом центре, которые уже спасли тысячи жизней. Этот опыт активно распространяется в регионах, что способствует повышению уровня медицинской помощи по всей стране.
Особое внимание вице-премьер уделила поддержке медицинских работников. В последние годы значительные ресурсы направлены на повышение заработной платы сотрудников системы здравоохранения, их социальную поддержку и создание комфортных условий для работы. В этом году впервые был учрежден почетный титул «Заслуженный врач Казахстана», что подчеркивает важность медицинской профессии для государства.
Источники: Официальные интернет-ресурсы Президента РК, Правительства РК и Министерства здравоохранения РК.
Фото: Официальный интернет-ресурс Правительства РК.
GDP талаптарына сәйкес фармацевтикалық өнім дистрибьюторының валидациясы мен біліктілік процесін ұйымдастыру
Алексей Хилюк, GDPЖол жобасының қатысушысы
Бұл мақала практикалық жұмыс тәжірибесіне негізделген. Осы

Алексей Хилюк, GDPЖол жобасының қатысушысы
Бұл мақала практикалық жұмыс тәжірибесіне негізделген. Осыған байланысты, GDPЖол жобасының қазіргі кеңесшілеріне Қазақстан, Өзбекстан және Ресейден мақала жазуға қатысқаны, әдістемелер, клиенттердің пікірлері туралы ақпарат бергені, сондай-ақ осы тақырыпты қамтудың маңыздылығы мен қажеттілігіне назар аударғаны үшін алғысымды білдіргім келеді.
Бұл мақалада біз валидация әдістемесін немесе валидация және біліктілік бойынша жұмыстарды жүргізудің нақты мысалдарын емес, нормативтік талаптарға сәйкес дистрибьютордың сапа жүйесі шеңберінде валидация және біліктілік процесін қалай ұйымдастыруға болатындығын талдаймыз.
Тексеру және біліктілік процесі GDP (Good distribution practice) талабына сәйкес дистрибьютордың сапа жүйесінің міндетті процесі болғандықтан, ең алдымен GDP ережелерінде көрсетілген анықтамалар мен талаптарға назар аудару қажет.
Осы мақалада біз Еуразиялық экономикалық комиссия кеңесінің 2016 жылғы 3 қарашадағы N 80 шешімімен бекітілген тиісті дистрибьюторлық практика ережелерінің талаптарын негізге алдық.
Бастау үшін GDP ережелерін тексеру және біліктілік терминдерінің анықтамаларын қарастырайық:
- "валидация" - рәсімнің, процестің, жабдықтың, материалдың, операцияның немесе жүйенің берілген талаптарға сәйкес келетіндігін және оларды пайдалану алдын ала белгіленген жарамдылық критерийлеріне сәйкес келетін нәтижелерге үнемі әкелетінін дәлелдейтін құжатталған әрекеттер;
- "біліктілік" - жабдықтың немесе көмекші жүйелердің дұрыс орнатылғанын, дұрыс жұмыс істейтінін және шынымен күтілетін нәтижелерге әкелетінін куәландыратын және растайтын құжатталған әрекеттер.
Енді GDP ережелерінің 50-тармағында не жазылғанына назар аударайық: «Ұйым тиісті монтаждау мен пайдалануды растау мақсатында біліктілікке және (немесе) валидацияға жататын негізгі жабдықтар мен процестерді айқындауға тиіс. Біліктілік және (немесе) валидация бойынша жүргізілетін жұмыстардың көлемі (мысалы, сақтау, жөнелтуге дайындау және буып-түю) тәуекелдерді құжаттамалық ресімделген талдау негізінде айқындалады.»
Осы талаптан валидация мен біліктілік кез келген процестің немесе жабдықтың берілген талаптарға сәйкес келетіндігін немесе дұрыс жұмыс істейтіндігін растайтын құжатталған тесттер ғана емес екендігі айқын болады. Валидация және біліктілік - бұл басқа процестермен байланысты дистрибьютордың сапа жүйесінің қажетті процесі (мысалы, тәуекелдерді басқару процесі) және дұрыс ұйымдастырылған кезде басқа процестермен қатар сапа жүйесі тиімді жұмыс істейді.
Сонымен, валидация мен біліктілік сапа жүйесінің процесі болғандықтан, онымен Ережелердің талаптарына сәйкес әрекет ету керек. Бұл туралы 7 тармақта жазылған: «Сапа жүйесі толығымен құжатталуы керек, оның тиімділігі мониторинг пен талдаудан өтуі керек. Сапа жүйесіне қатысты персоналдың іс-әрекеттері … тиісті жазбаша рәсімдерінде сипатталуы тиіс»
Демек, ұйымда дистрибьютордың процестері мен жабдықтарының валидациясы мен біліктілігін жоспарлау, дайындау және жүргізу тәртібі анықталатын стандартты операциялық процедураны (СОП) әзірлеу және енгізу қажет. СОП-та процесті басқарудың ішкі құралы ретінде қызметкерлердің ұйым, орындау және бақылау бөлігіндегі әрекеттері көрсетілген нәтижеге жеткенге дейін анықталады. Сондықтан СОП әзірлеу дистрибьютордың валидациясы мен біліктілік процесін ұйымдастырудың негізгі кезеңі болып табылады.
СОП-тағы әрекеттерді сипаттау процестің орындаушылары мен оның ұйымдастырушыларына түсінікті болуы үшін сипатталған процесті дәйекті кезеңдерге бөлген дұрыс. 1 суретте сіз осындай топтастырудың мысалын көре аласыз.

1-сурет.
Бұл мақалада біз СОП-та процесті қалай сипаттау керектігін егжей-тегжейлі қарастырмаймыз. Біз бұл тақырыпты СОП әзірлеуге арналған басқа мақалада егжей-тегжейлі ашамыз. Бұл мақалада біз оны тиімді ұйымдастыру мақсатында валидация мен біліктілік процесін сипаттайтын СОП-қа не кіретініне назар аударамыз.
1-суретте көрсетілгендей, сипатталған процесс бірнеше негізгі кезеңдермен бөлінген:
- Біліктілікті және (немесе) валидацияны жоспарлау;
- Біліктілікті және (немесе) валидацияны дайындау және жүргізу;
- Жүргізілген біліктілік және (немесе) валидация нәтижелерін бағалау және рәсімдеу.
Сонымен қатар, схеманың басында сопақ фигура процестің «кірісін» білдіреді, яғни процесті бастау үшін қажет нәрсе – дистрибьютордың процестері, бөлмелері, жүйелері мен жабдықтары. Схеманың соңында процестің «шығуы» белгіленеді, оны жүзеге асыру нәтижесінде ұйым не алады-валидацияланған және білікті процестер, үй-жайлар, жүйелер мен жабдықтар.
1 кезеңді қарастырыңыз - валидация мен біліктілікті жоспарлау.
Бұл кезеңде маңызды және бірінші қадам валидация мен біліктілікке жататын процестер мен жабдықтарды анықтау болып табылады. Бұл талап біз бұрын сілтеме жасаған GDP ережелерінің 50-тармағында көрсетілген: «Ұйым біліктілік пен валидацияға жататын негізгі жабдықтар мен процестерді анықтауы керек…»
Біліктілік пен валидацияны қажет ететін жабдықтар мен процестерді назардан тыс қалдырмау үшін GDP ережелерінің талаптарына назар аудару, тәуекелдерге талдау жүргізу, сондай-ақ Дүниежүзілік денсаулық сақтау ұйымының (ДДҰ) ұсынымдарын ескеру қажет.
GDP ережелерінде, 44-тармақта, дистрибьютордың ең маңызды жабдықтары, яғни дәрілік заттардың сапасын сақтауға әсер етуі мүмкін: «...Ең маңызды жабдыққа кондиционерлер, тоңазытқыш камералар (тоңазытқыштар) немесе құрылғылар, күзет және өрт дабылы, кіруді бақылау жүйелері, желдету жүйесі, ауаны ылғалдандыру және құрғату жүйесі, термогигрометрлер (психрометрлер) немесе температура мен ылғалдылықты тіркеу үшін пайдаланылатын өзге де жабдықтар, сондай-ақ тасымалдау үшін пайдаланылатын жабдықтар жатады.» Жоғарыда аталған барлық жабдықтар тексеруге және калибрлеуге жататын өлшеу құралдарынан басқа біліктілік пен валидацияға жатады. Сондай-ақ, GDP ережелерінің 5-тармағында процестердің қажеттілігі туралы жазылған: «…Көтерме саудада сату процесінің негізгі кезеңдері (аса маңызды өзгерістерді қоса алғанда) негізделуі және қажет болған жағдайда ... валидациялануы тиіс». Ал 44-тармақта. GDP компьютерленген жүйелерді тексеруге қойылатын талаптар: «Компьютерленген жүйені пайдалануды бастамас бұрын, жүйенің берілген нәтижелерді дәл, біркелкі және қайталанатын түрде алуға қабілетті екенін тексеру немесе тексеру арқылы көрсету керек».
ДДҰ ұсынымдарында 9-қосымшада, 7-қосымшада «Температурамен бақыланатын сақтау аймақтарының біліктілігі», 2.2.1-тармақта мыналар көрсетілген: «Термолабильді дәрілік заттарды өңдеу, сақтау және тарату үшін пайдаланылатын температурамен бақыланатын барлық жабдықтар мен жүйелер білікті болуы тиіс».
Біліктілік пен валидацияға жататын процестер мен жабдықтардың тізбесін нақтылау үшін процестер мен пайдаланылатын жабдықтардың дәрілік заттардың сапасын сақтауға әсеріне байланысты тәуекелдерге талдау жүргізу қажет.
Осы тізім негізінде валидация және біліктілік бойынша жұмыстарды жүргізудің жоспар-кестесін жасауға кірісуге болады. Жоспар-кесте, әдетте, біліктілік пен валидация процесін ұйымдастырудың ажырамас бөлігі болып табылады. Ол әдетте келесі ақпаратты қамтиды:
- бұрын жасалған процестер мен жабдықтардың тізбесіне сәйкес біліктілік немесе валидация объектісінің атауы;
- әрбір объект бойынша біліктілік және валидация жөніндегі іс-шараларды өткізу мерзімдері;
- жұмыстарды орындаушылар.
Бұл жерде біліктілік немесе валидация бойынша жұмыстарды орындаушылар дистрибьютордың немесе аутсорсердің осы мәселелерде құзыретті қызметкерлері (мысалы, қоймалық өңдеу немесе тасымалдау аутсорсингке берілген болса), сондай-ақ сыртқы мердігерлік ұйым болуы мүмкін екенін атап өткен жөн.
Біліктілік пен валидация жоспарын нақты біліктілік немесе валидация іс-қимыл жоспарымен және олардың сипаттамасымен шатастырудың қажеті жоқ екенін ескеру маңызды, бұл екі түрлі құжат.
Сондай-ақ, егер біліктілік пен валидация бойынша іс-шараларды мердігер ұйым жүргізетін болса, онда барлық валидациялық құжаттаманы (біліктілік жоспары, әдістемелер, хаттамалар, есептер және т.б.) әдетте осы мердігер ұйым ұсынатынын ескеру қажет. Егер біліктілік пен валидация бойынша іс-шараларды өз бетімен өткізу жоспарланса, барлық валидациялық құжаттаманы дайындауды жоспарлау қажет, ол үшін әдетте арнайы оқытылған қызметкерлер тобы жауап береді.
Жоспарлаудың бірінші кезеңінде жүзеге асырылады:
- біліктілікке және валидацияға жататын процестер мен жабдықтардың тізбесін дайындау;
- біліктілік және валидация жөніндегі іс-шараларды өткізудің жоспар-кестесін әзірлеу;
- біліктілік және валидация жөніндегі іс-шараларды орындаушыларды айқындау.
Осы кезеңді сипаттау кезінде СОП-та барлық іс-әрекеттердің орындалуына жауапты тұлғаларды, құжаттарды келісетін және бекітетін тұлғаларды, сондай-ақ көрсетілген іс-әрекеттердің орындалуын бақылауға жауапты тұлғаларды көрсету қажет.
2-кезең - біліктілікті және (немесе) валидацияны дайындау және өткізу.
Осы кезеңде біліктілік және валидация бойынша іс-шараларды өткізу үшін барлық қажетті әрекеттерді анықтау қажет. СОП-та көрсетілуі тиіс дайындық жұмыстарының және тиісінше іс-қимылдардың көлемі әрбір нақты жағдайда кімнің күшімен (дистрибьютор қызметкерлерімен немесе мердігерлік ұйыммен) біліктілік пен валидация жүргізілетініне байланысты.
Егер жұмыстар өз күшімен жүргізілетін болса, онда СОП-та біліктілік және валидация бойынша жұмыстарды жүргізу әдістемесін әзірлеу кезеңін көздеу қажет. Валидация немесе біліктілік үшін тиімді әдісті қалай жасауға болады - бұл басқа мақаланың тақырыбы. Құжаттаманы, әдістемені әзірлеуге және валидациялық жұмыстарды жүргізуге қатысатын қызметкерлердің осы әрекеттерді орындау үшін жеткілікті құзыреттерге ие болуы маңызды. Біліктілік пен валидацияны жүргізудің барлық әзірленген әдістемелері, сондай-ақ дистрибьютор өз қызметін жүзеге асыру үшін пайдаланатын жабдықтар мен процестер біліктілік және валидация жөніндегі СОП нұсқаулықтарында қоса берілуі немесе сипатталуы мүмкін. Осылайша, сапа жүйесінде реттеуші құжаттаманың қадағалануы қамтамасыз етіледі.
Валидация және біліктілік жөніндегі жұмыстарды орындау үшін мердігер ұйым жалданған жағдайда, мердігер ұйымды бағалау және таңдау жөніндегі іс-шараларды көздеу қажет. Осылайша, қызмет көрсетушілерді бағалау және таңдау процестерінің сапа жүйесіндегі біліктілік пен валидация процесімен өзара әрекеттесуі байқалады. Әдетте, біліктілік және валидация бойынша СОП-та қызмет көрсетушілерді бағалау және таңдау бойынша СОП-қа сілтеме көрсетіледі, оған сәйкес мердігерді бағалаудың нақты критерийлері айқындалады. Әрине, таңдалған мердігер ұйыммен қызмет көрсету туралы келісім-шарт жасасу керек, оны рәсіммен де анықтау керек.
Мердігер ұйым тартылған жағдайда, әдетте барлық құжаттаманы әзірлейді және мердігердің мамандары барлық жұмыстарды дистрибьютор өкілінің бақылауымен жүргізеді. Біліктілік және валидация бойынша жұмыстарды жүргізу тұрақты негізде де, бір реттік негізде де пайдаланылуы мүмкін, мысалы, белгіленген мерзімге жету немесе тәжірибе жинау қажет болғанда.
Айта кету керек, егер мердігер ұйым біліктілік пен валидация жұмыстарын жүргізсе, онда осы процесті ұйымдастыруға жауапты дистрибьютор қызметкерлері мердігер жүргізетін іс-әрекеттердің әдістері мен ерекшеліктерін толық түсініп, түсінуі керек.
Осы кезеңді сипаттау кезінде СОП-та барлық іс-әрекеттердің орындалуына жауапты тұлғаларды, құжаттарды келісетін және бекітетін тұлғаларды, сондай-ақ көрсетілген іс-әрекеттердің орындалуын бақылауға жауапты тұлғаларды көрсету қажет.
3-кезең - өткізілген біліктілік және (немесе) валидация нәтижелерін бағалау және рәсімдеу.
Осы кезеңде жүргізілген біліктілік пен валидация нәтижелерін ресімдеуге байланысты іс-әрекеттер, сондай-ақ егер біліктілік немесе валидация жүргізу кезінде ауытқулар анықталған жағдайда іс-әрекеттер айқындалады.
Егер біліктілік пен валидация өз бетінше жүргізілсе, онда СОП-та нәтижелерді ресімдеу тәртібін анықтау қажет, мысалы, алынған деректерді талдау және қорытындыны рәсімдеу, процесте анықталған жұмыстардың барлық ауытқулары туралы есепті қалыптастыру, қорытындылар мен ұсыныстармен қорытынды есепті рәсімдеу.
Егер біліктілік пен валидацияны мердігер жүргізсе, онда мердігер ұсынған валидациялық құжаттарды қабылдау және тексеру жөніндегі іс-қимылдар көзделсін.
Есептер түрінде деректерді рәсімдеу қажеттілігі туралы 50-тармақта жазылған. GDP: «Валидация немесе біліктілік жүргізу есептермен рәсімделеді, онда алынған нәтижелер жинақталуы, сондай-ақ анықталған ауытқуларға түсініктемелер берілуі тиіс.»
Сондай-ақ, осы кезеңде САРА (ағылшын тілінен Corrective and Preventive Action), әзірлеуді қарастыру қажет, егер ауытқулар анықталса, бұл талаптар 51-тармақта белгіленген. GDP: «Белгіленген рәсімдерден ауытқулар құжатпен рәсімделеді, оларды жоюға, сондай-ақ олардың болашақта пайда болуын болдырмауға бағытталған шаралар әзірленеді (түзету және алдын алу әрекеттері)…». Әдетте, егер біз СОП-тағы әрекеттердің сипаттамасы туралы айтатын болсақ, онда біліктілік пен валидация бойынша СОП-та қызметкерлердің әрекеттері егжей-тегжейлі анықталған СОП САРА сілтемесі көрсетіледі.
САРА іске асырылғаннан кейін, қажет болған жағдайда қанағаттанарлық нәтижелер алынғанға дейін біліктілік немесе валидация бойынша қосымша іс-шаралар жүргізіледі, тиісінше бұл іс-шаралар СОП және жазба нысандарында да көзделуге тиіс. Шотқа қойылатын талаптар бұл 51 тармақта көрсетілген. GDP «…Тиісті қызметкерлер бекітетін процестің немесе жабдықтың сәтті валидациясы мен жарамдылығы туралы дәлелдер алынуы керек.».
Соңында мен біліктілік пен валидация процесін бағалаудың негізгі көрсеткіштерін қоюды ұсынамын, өйткені процестерді СОП-та анықтап, сипаттап қана қоймай, оларды басқару керек. Мұнда әйгілі кәсіпкер Джек Уэлчтің сөздерін келтірген жөн: «Өлшеуге болмайтын нәрсені басқару мүмкін емес.». Дистрибьютордың біліктілігі мен валидация процесін бағалау көрсеткіштері келесі аспектілерді қамтуы мүмкін:
- Біліктілікті және/немесе валидацияны уақтылы жүргізу.
- Біліктілік және/немесе валидация бойынша есептердің болуы және толықтығы.
- Біліктілік және/немесе валидация нәтижелері бойынша ауытқуларға уақтылы ден қою.
Осы көрсеткіштер анықталғаннан кейін оларды күндер, сағаттар, оқиғалар саны, қаржылық шығындар және әр көрсеткішке сәйкес келетін басқа параметрлер сияқты жоспарлы мәндерді белгілеу арқылы сандық бағалау қажет. Өлшенетін көрсеткіштерді анықтау GDP тұрғысынан маңызды аспект болып табылады. GDP 13-тармағында көрсетілген басшылық тарапынан талдау процесіне қойылатын талаптарда айтылады: «Ұйым басшылығы сапа жүйесін мерзімді шолудың рәсімделген процесін белгілеуі керек. Шолу мыналарды қамтуы керек: … б) талаптардың саны, белгіленген нормалардан ауытқулар, түзету және ескерту әрекеттерінің тиімділігі, процестердегі өзгерістер, аутсорсинг қызметі туралы пікірлер, өзін-өзі тексеру процестері (тәуекелдерді талдау мен аудиттерді қоса алғанда), сыртқы бақылау нәтижелері (инспекциялар мен аудиттерді қоса алғанда)сияқты сапа жүйесінің процестерінің тиімділігін бақылау үшін пайдаланылуы мүмкін тиімділік көрсеткіштерін бағалау, анықталған сәйкессіздіктер, клиенттердің аудиттері;...».
Осы мақаладағы ақпарат пайдалы болады және фармацевтикалық өнім дистрибьюторларында сапа жүйесінде біліктілік пен валидация процесін тиімді ұйымдастыруға көмектеседі деп шын жүректен үміттенеміз.
Егер сізде сұрақтар туындаса немесе кез-келген нәрсені егжей-тегжейлі талқылағыңыз келсе, бізге
 Алексей Хилюк
Алексей Хилюк
GDPЖол жобасының қатысушысы
Дереккөз: https://gdpway.com/validarticle
Валидация и квалификация дистрибьютора фармацевтической продукции по требованиям GDP
Алексей Хилюк, участник проекта GDPПуть
Эта статья основана на практическом опыте работы. В связи с этим, хочу

Алексей Хилюк, участник проекта GDPПуть
Эта статья основана на практическом опыте работы. В связи с этим, хочу выразить благодарность действующим консультантам проекта GDPПуть из Казахстана, Узбекистана и России за участие в написании статьи, предоставление информации о методиках, отзывов клиентов, а также за внимание к важности и необходимости освещения данной темы.
В данной статье мы разберем не методики валидации или какие-то конкретные примеры проведения работ по валидации и квалификации, а то, как в соответствии с нормативными требованиями организовать процесс валидации и квалификации в рамках системы качества дистрибьютора.
Поскольку процесс валидации и квалификации является обязательным процессом системы качества дистрибьютора согласно требованию GDP (Good distribution practice), то прежде всего необходимо обратить внимание на определения и требования, указанные в правилах GDP.
В настоящей статье мы взяли за основу требования Правил надлежащей дистрибьюторской практики, утвержденных решением от 3 ноября 2016 года № 80 Советом Евразийской экономической комиссии.
Для начала давайте рассмотрим определения терминов валидация и квалификация Правилах GDP:
- «валидация» - документально оформленные действия, доказывающие, что процедура, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование будет постоянно приводить к результатам, соответствующим заранее установленным критериям приемлемости;
- «квалификация» - документально оформленные действия, удостоверяющие и подтверждающие, что оборудование или вспомогательные системы смонтированы должным образом, правильно функционируют и действительно приводят к ожидаемым результатам.
Теперь обратим внимание на то, что написано в пункте 50 Правил GDP: «Организация должна определить ключевое оборудование и процессы, которые подлежат квалификации и (или) валидации с целью подтверждения надлежащего монтажа и эксплуатации. Объем проводимых работ по квалификации и (или) валидации (например, хранение, подготовка к отгрузке и упаковка) определяется на основе документально оформленного анализа рисков».
Из этого требования становится ясно, что валидация и квалификация - это не просто документально оформленные тесты, подтверждающие, что какой-либо процесс или оборудование соответствуют заданным требованиям или должным образом функционируют. Валидация и квалификация - это необходимый процесс системы качества дистрибьютора, связанный с другими процессами (например, процессом управления рисками), и при правильной организации которого, наряду с другими процессами, система качества будет функционировать эффективно.
Итак, раз валидация и квалификация - это процесс системы качества, то следует поступать с ним в соответствии с требованиями Правил. Об этом написано в пункте 7: «Система качества должна быть полностью документирована, ее эффективность должна подвергаться мониторингу и анализу. Действия персонала, относящиеся к системе качества, должны быть описаны в соответствующих письменных процедурах…»
Следовательно, в организации необходимо разработать и внедрить в работу стандартную операционную процедуру (СОП), в которой будет определен порядок планирования, подготовки и проведения валидации и квалификации процессов и оборудования дистрибьютора. Именно в СОП, как внутреннем инструменте управления процессом, определяются действия сотрудников в части организации, исполнения и контроля до получения заданного результата. Поэтому разработка СОП является основополагающим этапом в организации процесса валидации и квалификации дистрибьютора.
Для того чтобы описание действий в СОП было понятно исполнителям процесса и его организаторам, описываемый процесс лучше разбить на последовательные этапы. На рисунке 1 вы можете видеть пример такой разбивки.

Рис. 1. Пример разбивки описания действий в СОП.
В данной статье мы не будем детально разбирать, как описывать процесс в СОП. Эту тему мы подробно раскроем в другой статье, посвящённой разработке СОП. В данной статье мы обратим внимание на то, что должно быть включено в СОП, описывающую процесс валидации и квалификации, с целью его эффективной организации.
Как видно на рисунке 1, описываемый процесс разделен нескольких основных этапов:
1) Планирование квалификации и (или) валидации;
2) Подготовка и проведение квалификации и (или) валидации;
3) Оценка и оформление результатов проведенной квалификации и (или) валидации.
При этом в начале схемы овальной фигурой обозначен «вход» процесса, то есть то, что необходимо для начала процесса – это процессы, помещения, системы и оборудование дистрибьютора. В конце схемы обозначен «выход» процесса, то, что организация получает в результате его реализации – валидированные и квалифицированные процессы, помещения, системы и оборудование.
Рассмотрим 1-й этап - планирование валидации и квалификации.
На этом этапе важным и первым шагом является определение процессов и оборудования, подлежащих валидации и квалификации. Это требование указано в пункте 50 Правил GDP, на который мы уже ссылались ранее: «Организация должна определить ключевое оборудование и процессы, которые подлежат квалификации и валидации…».
Для того чтобы не упустить из виду оборудование и процессы, требующие квалификации и валидации, необходимо обратить внимание на требования Правил GDP, провести анализ рисков, а также учесть рекомендации Всемирной организации здравоохранения (ВОЗ).
В Правилах GDP, в пункте 44, перечислено наиболее значимое оборудование дистрибьютора, то есть то, которое может оказывать влияние на сохранение качества лекарственных средств: «…К наиболее значимому оборудованию относятся кондиционеры, холодильные камеры (холодильники) или устройства, охранная и пожарная сигнализация, системы контроля доступа, вентиляционная система, система увлажнения и осушения воздуха, термогигрометры (психрометры) или иное оборудование, используемое для регистрации температуры и влажности, а также оборудование, используемое для транспортировки». Все вышеперечисленное оборудование подлежит квалификации и валидации, кроме средств измерений, которые подлежат поверке и калибровке. Также в пункте 5 Правил GDP, написано о необходимости процессов: «…Ключевые этапы процесса оптовой реализации (включая наиболее значимые изменения) должны быть обоснованы и при необходимости валидированы…». А в пункте 44. GDP установлены требования к валидации компьютеризированных систем: «Перед началом использования компьютеризированной системы необходимо продемонстрировать с помощью валидации или верификации, что система способна получать заданные результаты точно, единообразно и воспроизводимо».
В Рекомендациях ВОЗ в приложении 9, дополнении 7 «Квалификация зон хранения с контролируемой температурой», в пункте 2.2.1 указано следующее: «Все оборудование и системы с контролируемой температурой, используемые для обработки, хранения и распределения термолабильных лекарственных средств должны быть квалифицированы».
Необходимо провести анализ рисков, связанных с влиянием процессов и используемого оборудования на сохранение качества лекарственных средств, чтобы уточнить перечень процессов и оборудования, подлежащих квалификации и валидации.
На основании этого перечня можно приступать к составлению плана-графика проведения работ по валидации и квалификации. План-график, как правило, является неотъемлемой составляющей организации процесса квалификации и валидации. Он обычно содержит следующую информацию:
- наименование объекта квалификации или валидации согласно ранее составленному перечню процессов и оборудования;
- сроки проведения мероприятий по квалификации и валидации по каждому объекту;
- исполнителей работ.
Здесь стоит отметить, что исполнителями работ по квалификации или валидации могут быть как компетентные в этих вопросах сотрудники дистрибьютора или аутсорсера (например, если складская обработка или транспортировка переданы на аутсорсинг), так и внешняя подрядная организация.
Важно отметить, что не нужно путать план-график проведения квалификации и валидации с планом конкретных действий по квалификации или валидации и их описанием, это два разных документа.
Следует также учитывать, что если мероприятия по квалификации и валидации будут проводиться подрядной организацией, то всю валидационную документацию (план квалификации, методики, протоколы, отчёты и пр.) обычно предоставляет эта подрядная организация. Если же мероприятия по квалификации и валидации планируется проводить своими силами, необходимо запланировать подготовку всей валидационной документации, за что обычно отвечает специально обученная группа сотрудников.
На первом этапе планирования осуществляется:
- подготовка перечня процессов и оборудования, подлежащих квалификации и валидации;
- разработка плана-графика проведения мероприятий по квалификации и валидации;
- определение исполнителей мероприятий по квалификации и валидации.
При описании этого этапа в СОП необходимо указать ответственных лиц за исполнение всех действий, лиц, согласующих и утверждающих документы, а также лиц, ответственных за контроль исполнения указанных действий.
2-й этап - подготовка и проведение квалификации и (или) валидации.
На данном этапе необходимо определить все необходимые действия для проведения мероприятий по квалификации и валидации. Объем подготовительных работ и, соответственно, действий, которые необходимо указать в СОП, зависит от того, чьими силами (сотрудниками дистрибьютора или подрядной организацией) будет проводиться квалификация и валидация в каждом конкретном случае.
Если работы будут проводиться собственными силами, то в СОП необходимо предусмотреть этап разработки методики проведения работ по квалификации и валидации. Как разработать эффективную методику для проведения валидации или квалификации – это тема уже другой статьи. Важно, чтобы сотрудники, участвующие в разработке документации, методики и проведении валидационных работ, обладали достаточными компетенциями для выполнения этих действий. Все разработанные методики проведения квалификации и валидации, а также оборудования и процессов, используемых дистрибьютором для осуществления своей деятельности, могут быть приложены или описаны в инструкциях к СОП по квалификации и валидации. Таким образом, будет обеспечена прослеживаемость регламентирующей документации в системе качества.
В случае, когда нанимается подрядная организация для выполнения работ по валидации и квалификации, необходимо предусмотреть мероприятия по оценке и выбору подрядной организации. Таким образом, прослеживается взаимодействие процессов оценки и выбора поставщиков услуг с процессом квалификации и валидации в системе качества. Как правило, в СОП по квалификации и валидации указывается ссылка на СОП по оценке и выбору поставщиков услуг, в соответствии с которым определяются четкие критерии оценки подрядчика. И, конечно, с выбранной подрядной организацией необходимо заключить договор на оказание услуг, что тоже должно быть определено процедурой.
В случае привлечения подрядной организации, обычно разрабатывают всю документацию и проводят все работы специалисты подрядчика под наблюдением представителя дистрибьютора. Проведение работ по квалификации и валидации может использоваться как на постоянной основе, так и разово, например, когда необходимо уложиться в установленные сроки или набраться опыта.
Следует отметить, что если работы по квалификации и валидации проводит подрядная организация, то сотрудникам дистрибьютора, отвечающим за организацию данного процесса, необходимо в полной мере понять и разобраться в методиках и специфике проводимых действий подрядчиком.
При описании этого этапа в СОП необходимо указать ответственных лиц за исполнение всех действий, лиц, согласующих и утверждающих документы, а также лиц, ответственных за контроль исполнения указанных действий.
3-й этап - оценка и оформление результатов проведенной квалификации и (или) валидации.
На данном этапе определятся действия, связанные с оформлением результатов проведенной квалификации и валидации, а также действия, в случае если при проведении квалификации или валидации были выявлены отклонения.
Если квалификация и валидация проводится своими силами, то в СОП необходимо определить порядок оформления результатов, например, анализ полученных данных и оформление заключения, формирование отчета о всех отклонениях выявленных в процессе проводимых работ, оформление итогового отчета с выводами и рекомендациями.
Если квалификация и валидация проводится подрядчиком, то предусмотреть действия по принятию и проверки валидационных документов, предоставленных подрядчиком.
О необходимости оформления данных в виде отчетов написано в пункте 50. GDP: «Проведение валидации или квалификации оформляется отчетами, в которых должны быть обобщены полученные результаты, а также даны объяснения выявленным отклонениям».
Также на этом этапе нужно предусмотреть разработку корректирующих и предупреждающих действий САРА (от англ. Corrective and Preventive Action), если были выявлены отклонения, эти требования установлены в пункте 51. GDP: «Отклонения от установленных процедур документально оформляются, разрабатываются меры, направленные на их устранение, а также на предотвращение их появления в будущем (корректирующие и предупреждающие действия)…». Как правило, если говорить об описании действий в СОП, то в СОП по квалификации и валидации указывается ссылка на СОП САРА, в котором подробно определены действия сотрудников.
После реализации САРА, проводятся при необходимости дополнительные мероприятия по квалификации или валидации до тех пор, пока не будут получены удовлетворительные результаты, соответственно эти действия также должны быть предусмотрены в СОП и формах для записей. Требования на счет этого указаны в п 51 GDP «…Должны быть получены доказательства успешной валидации и приемлемости процесса или оборудования, которые утверждаются соответствующими работниками».
В завершении рекомендую уставить ключевые показатели оценки процесса квалификации и валидации, потому как процессы необходимо не только определить и описать в СОП, но ими нужно еще и управлять. Здесь будет уместно примести слова известного предпринимателя Джека Уэлча: «Что невозможно измерить, тем невозможно управлять». Показатели оценки процесса квалификации и валидации дистрибьютора могут включать следующие аспекты:
- Своевременность проведения квалификации и/или валидации.
- Наличие и полнота отчетов по квалификации и/или валидации.
- Своевременное реагирование на отклонения по результатам квалификации и/или валидации.
После определения этих показателей их необходимо количественно оценить, установив плановые значения, такие как дни, часы, количество инцидентов, финансовые затраты и другие параметры, соответствующие каждому показателю. Определение измеримых показателей является важным аспектом с точки зрения GDP. В требованиях к процессу анализа со стороны руководства, указанных в пункте 13 GDP, говорится: «Руководство организации должно установить формализованный процесс периодического обзора системы качества. Обзор должен включать в себя: … б) оценку показателей эффективности, которые могут быть использованы для мониторинга эффективности таких процессов системы качества, как количество претензий, отклонений от установленных норм, эффективность корректирующих и предупреждающих действий, изменения в процессах, отзывы о деятельности по аутсорсингу, процессы самопроверки (включая анализ рисков и аудиты), результаты внешнего контроля (включая инспекции и аудиты), выявленные несоответствия, аудиты клиентов...».
Искренне надеемся, что информация в этой статье будет полезна и поможет более эффективно организовать процесс квалификации и валидации в системе качества у дистрибьюторов фармацевтической продукции.
Если у вас возникнут вопросы или вы захотите обсудить что-либо более детально, пожалуйста, не стесняйтесь связаться с нами по электронной почте:
 Алексей Хилюк
Алексей Хилюк
Участник проекта GDPПуть
Источник : https://gdpway.com/validarticle.
Смогут ли обращаться на рынке стратегически важные лекарства после 31 декабря 2025 года?
Этот вопрос сегодня волнует всех участников сферы обращения лекарственных средств и ответ на него предостав

Этот вопрос сегодня волнует всех участников сферы обращения лекарственных средств и ответ на него предоставил и. о. руководителя управления фармацевтической экспертизы департамента экспертизы лекарственных средств РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Даулет Шамратович БАЛМАГАМБЕТОВ в рамках Международной практической конференции «Единый рынок лекарственных средств ЕАЭС», проводимой 17-18 октября 2024 года компанией BRAVO BUSINESS FORUMS.
Спикер отметил, что регистрационные удостоверения (РУ), выданные по национальной процедуре, остаются действующими только до 31 декабря 2025 года. Исключение составляют стратегически важные лекарственные средства. Их регистрационные удостоверения выдаются по национальной процедуре, но остаются действующими и после этой даты. Однако обращение таких препаратов возможно только в случае чрезвычайных условий.
Напомним, что в соответствии с законодательством, к таким условиям относятся:
- военные действия и ликвидация их последствий;
- возникновение, предупреждение и ликвидация последствий чрезвычайных ситуаций;
- угроза возникновения, распространения новых особо опасных инфекционных заболеваний и ликвидация их последствий;
- профилактика, диагностика, лечение заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов, а также ликвидация их последствий;
- отсутствие или угроза отсутствия лекарственных средств или медицинских изделий на рынках государств-членов Евразийского экономического союза в условиях введения ограничительных экономических мер в отношении хотя бы одного из государств-членов.
В ходе конференции обсуждаются основные изменения в правилах регистрации и экспертизы лекарственных препаратов в ЕАЭС, рассматриваются проблемы технического взаимодействия в государствах признания, основные ошибки при подготовке регистрационного досье в соответствии с правилами ЕАЭС и другие вопросы. С докладами выступают ведущие специалисты экспертных органов в области обращения лекарственных средств и медицинских изделий стран ЕАЭС. Они отвечают на все вопросы участников конференции.
Аналитика
ҚАЗАҚСТАН МЕН ӨЗБЕКСТАННЫҢ ФАРМНАРЫҒЫ ЕУРАЗИЯЛЫҚ ФАРМАЦЕВТИКАЛЫҚ САММИТІ-2024 НАЗАРЫНДА
17-19 қыркүйекте Ташкентте, Өзбекстанда Еуразиялық фармацевтикалық Саммиті-2024 өтті. Іс-шараны Global Pharmaceutical Leaders�

17-19 қыркүйекте Ташкентте, Өзбекстанда Еуразиялық фармацевтикалық Саммиті-2024 өтті. Іс-шараны Global Pharmaceutical Leaders’ Club компаниясы ұйымдастырды, ал Proxima Research компаниясы аналитикалық серіктес ретінде әрекет етті. Іс-шара Орта Азия, Кавказ және Шығыс Еуропа елдерінен 200-ден астам фармацевтикалық индустрия көшбасшыларын, сондай-ақ саммит барысында Орталық Азияның фармацевтикалық нарықтарын дамытудың бірқатар өзекті тақырыптарын талқылаған билік өкілдерін жинады.
ҚАЗАҚСТАН МЕН ӨЗБЕКСТАННЫҢ ФАРМНАРЫҚТАРЫ
Proxima Research Өзбекстан директоры Виталий Кимнің баяндамасы көрермендердің жоғары қызығушылығын тудырды, онда ол Қазақстан мен Өзбекстан нарықтарының дамуы мен құрылымы туралы айтты.
2024 жылдың І жартыжылдығының қорытындысы бойынша Қазақстан мен Өзбекстанның фармацевтикалық нарықтарында дәрілік заттар мен биологиялық белсенді қоспаларды (ББҚ) бөлшек саудада өткізудің жиынтық көлемі шамамен 1,8 млрд. АҚШ долларын құрады және өткен жылдың сәйкес кезеңімен салыстырғанда 16,6%-ға өсті. Заттай түрде сату көлемі 596 миллион қаптаманы құрап, 4,1%-ға өсті (1- сурет).
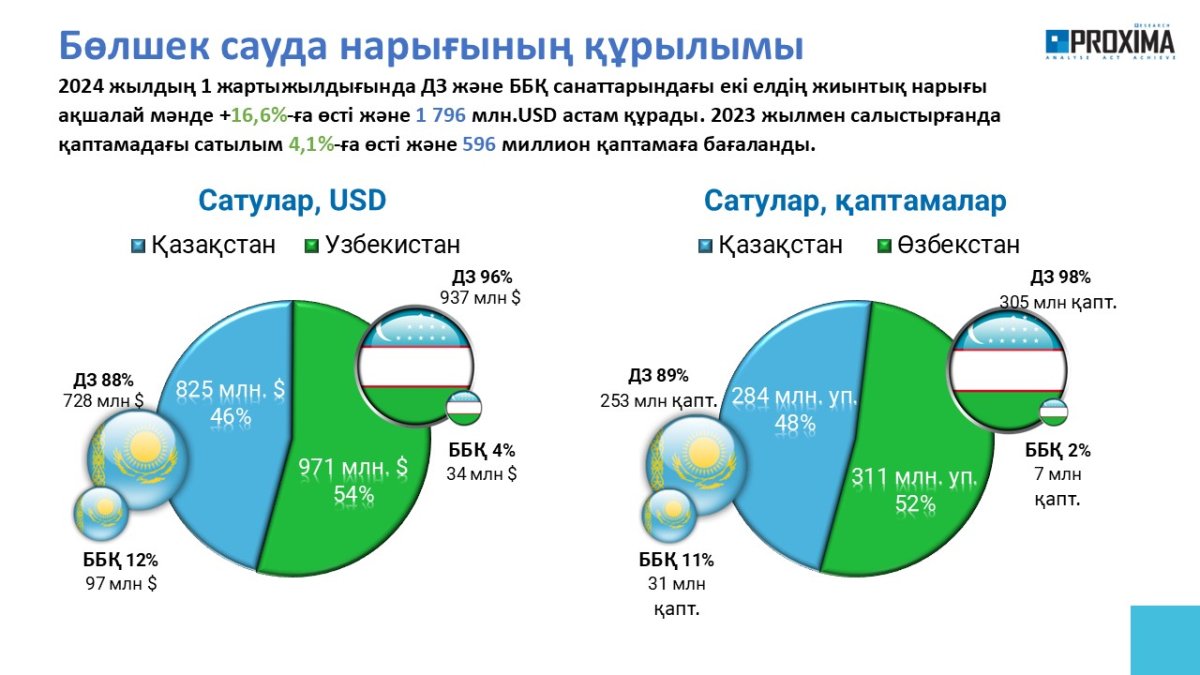
1-сурет Қазақстан мен Өзбекстан нарықтарындағы дәрілік заттар мен биологиялық белсенді қоспаларды бөлшек саудада сатудың құрылымы
Санаттар бойынша құрылымды қарастыра отырып, Өзбекстан нарығындағы ББҚ үлесі шамалы және доллармен 4% және заттай 2% құрайды. Сонымен қатар Қазақстан нарығында ББҚ үшін айтарлықтай салмақты және тиісінше 12 және 11%-ын құрайды.
ББҚ сегментінің белсенді даму проблемасы тек Орта Азия нарықтарында ғана емес, сонымен қатар басқа дамушы нарықтарда да байқалады, бұл дәрі-дәрмектермен салыстырғанда қарапайым тіркеуге және аз реттеуге байланысты.
Отандық және шетелдік өндірістегі препараттарды дәріханалық сатудың құрылымы Қазақстан мен Өзбекстанның фармацевтикалық нарықтарының импортқа тәуелді екендігін айғақтайды. 2024 жылдың І жартыжылдығының қорытындысы бойынша Қазақстан нарығындағы импорттық препараттардың үлесі 87% ақшалай және 74% заттай мәнде құрайды. Өзбекстанда бұл көрсеткіштер сәйкесінше 86% және 63% құрайды (2-сурет). Сондай-ақ, отандық препараттарды сату көлемінің өсу қарқыны импортталғанға қарағанда жоғары екенін атап өткен жөн. Бұл осы елдердің үкіметтері өндірістерді оқшаулау және импорттық дәрі-дәрмектерге тәуелділікті азайту үшін реформалар енгізіп, стратегиялар әзірлеп жатқанын көрсетеді.
Рецепт мәртебесі бойынша бөлшек сауда құрылымын талдай отырып, Өзбекстан нарығындағы рецепт бойынша дәрі-дәрмектердің жеткілікті жоғары үлесін атап өтуге болады. Қазақстанда рецептілік препараттардың үлесі төмен, алайда динамика рецептуралық сегменттің дамуының жоғары қарқынын айғақтайды, бұл оның үлесінің ұлғаюына ықпал ететін болады.
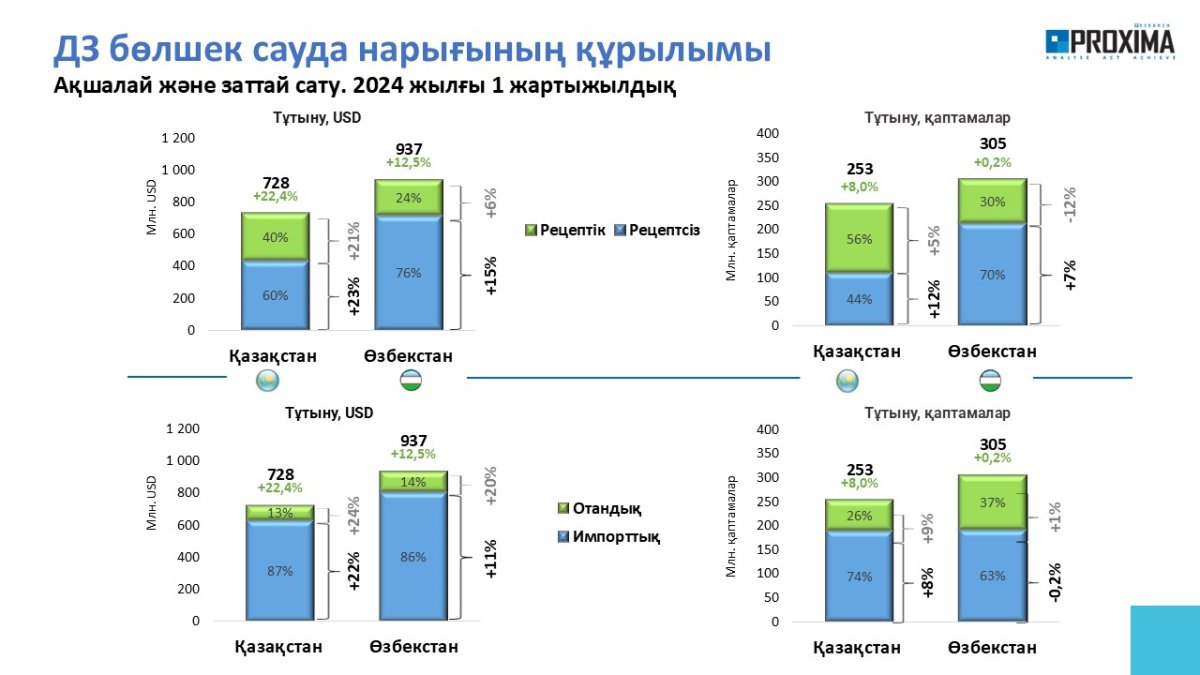
2-сурет Қазақстан мен Өзбекстанның отандық және шетелдік өндірістегі дәрілік заттардың бөлшек сауда нарығының құрылымы, сондай-ақ олардың рецептуралық мәртебесі
Дәріханадағы дәрі-дәрмектерді сату көлемінің өсу индикаторларының көмегімен нарықтардың не үшін дамып жатқанын түсінуге болады. Деректерге сүйенсек, 2024 жылдың І жартыжылдығының қорытындысы бойынша Қазақстан нарығы долларлық мәнде негізінен алмастыру индексі есебінен өсуді көрсетті, бұл дәрі-дәрмектерді физикалық тұтынуды ұлғайту арқылы дамуды көрсетеді. Сонымен қатар, Өзбекстан нарығында өсудің негізгі факторларының бірі инфляциялық компонент болып табылады, бірақ алмастыру индексі де айтарлықтай үлес қосады (3-сурет).
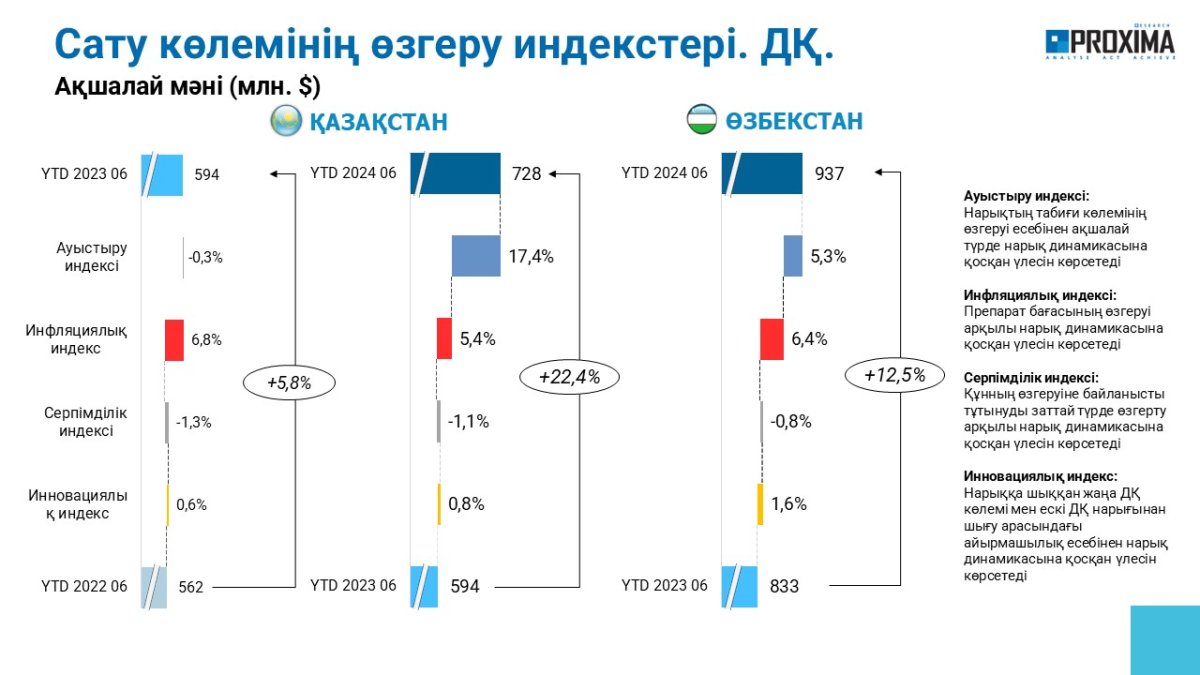 3-сурет 2023 ж. ұқсас кезеңмен салыстырғанда 2024 ж. І жартыжылдығының қорытындылары бойынша дәрілік заттарды дәріханалық сату көлемінің долларлық мәнде өзгеру индикаторлары
3-сурет 2023 ж. ұқсас кезеңмен салыстырғанда 2024 ж. І жартыжылдығының қорытындылары бойынша дәрілік заттарды дәріханалық сату көлемінің долларлық мәнде өзгеру индикаторлары
2024 жылдың І жартыжылдығында маркетингтік ұйымдар арасында дәрілік заттарды ақшалай түрде бөлшек саудада өткізу көлемі бойынша Қазақстан нарығында «Штада-Нижфарм», «Санто» және «ВОРЛД МЕДИЦИН ГРУПП» компаниялары көшбасшы болып табылады. Өзбекстанда бұл компаниялар - «КРКА», «Штада» және «Юрия-Фарм» (4-сурет). Рейтингте көптеген ірі халықаралық компанияларды байқауға болады, бұл импорттық дәрі-дәрмектерге жоғары тәуелділікті тағы бір рет растайды.
Брендтердің ішінде Қазақстан нарығында ақшалай мәнде сату бойынша көшбасшылар этил спирті, ГЕПТРАЛ және КРЕОН, ал Өзбекстанда - натрий хлориді, ТИВОРТИН және РЕОСОРБИЛАКТ болып табылады (5-сурет).
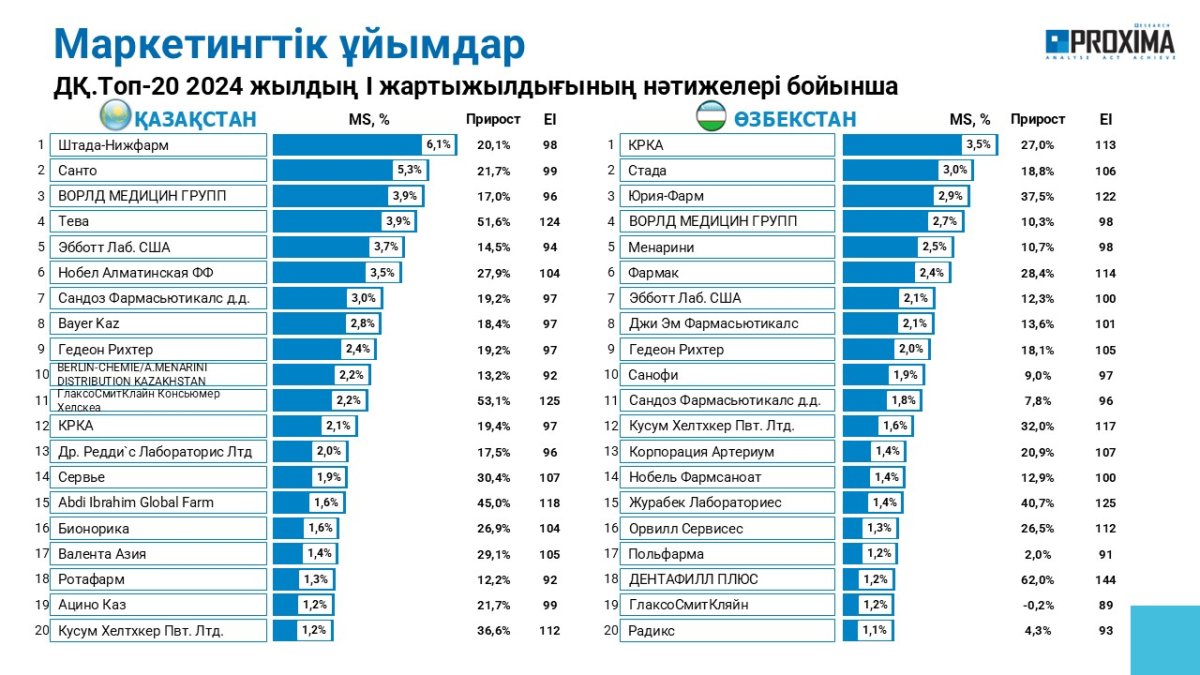 4-сурет Қазақстан және Өзбекстан республикаларында 2024 ж. І жартыжылдығының қорытындысы бойынша дәрілік заттарды ақшалай түрде дәріханалық сату көлемі бойынша Топ-20 маркетингтік ұйым
4-сурет Қазақстан және Өзбекстан республикаларында 2024 ж. І жартыжылдығының қорытындысы бойынша дәрілік заттарды ақшалай түрде дәріханалық сату көлемі бойынша Топ-20 маркетингтік ұйым
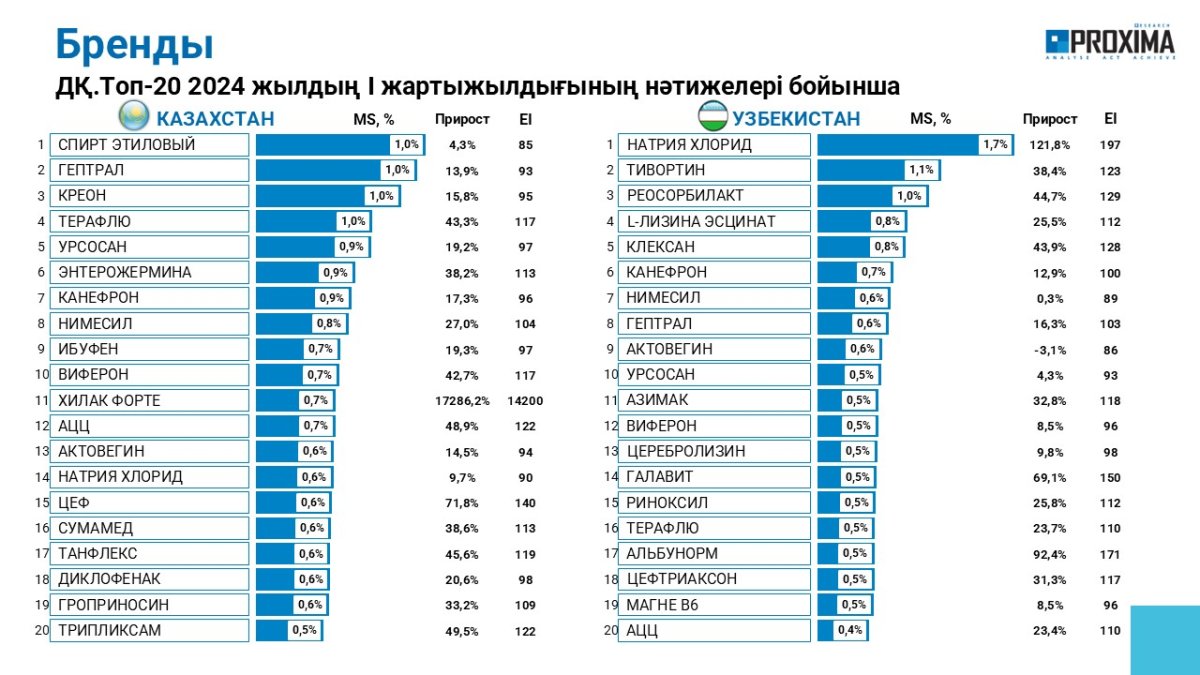 5-сурет Қазақстан және Өзбекстан республикаларында 2024 ж. І жартыжылдығының қорытындысы бойынша ақшалай мәнде дәріханалық сату көлемі бойынша дәрілік заттардың Топ-20 бренді
5-сурет Қазақстан және Өзбекстан республикаларында 2024 ж. І жартыжылдығының қорытындысы бойынша ақшалай мәнде дәріханалық сату көлемі бойынша дәрілік заттардың Топ-20 бренді
САММИТ ҚОРЫТЫНДЫСЫ
Орта Азия елдерінің фармацевтикалық нарықтары үздіксіз сын-қатерлер мен өзгерістер жағдайында дамуда. Деректер Қазақстан мен Өзбекстанның нарықтары ақшалай да, заттай да бөлшек сауда өсімін көрсете отырып, белсенді дамып келе жатқанын көрсетеді. Нарықтардың оң динамикасы әлеуетті инвесторлар үшін оң сигнал болып табылады.
Еуразиялық фармацевтикалық Саммиті-2024 бірнеше жыл қатарынан Еуразия елдерінің фармацевтикалық нарықтарын одан әрі дамытуға бағытталған пікір алмасу және стратегияларды бірлесіп әзірлеу үшін платформа болды. Саммитке қатысушылар Қазақстан, Өзбекстан, Қырғызстан, Әзірбайжан, Армения сияқты елдердің фармацевтикалық нарықтарының мемлекеттік және коммерциялық сегменттеріндегі үрдістерді белсенді талқылады. Фармацевтикалық нарықтардың өнім сапасына қойылатын талаптардың артуы және реттеуші базаның өзгеруі жағдайындағы болашағы басты мәселелердің бірі болды.
Саммит тәжірибе алмасудың және саланың негізгі стейкхолдерлерімен қызықты мәселелерді талқылаудың бірегей мүмкіндіктерін ұсынды. Іс-шара барысында қатысушылар өздерін қызықтырған мәселелерді талқылау және реттеушілермен дөңгелек үстел форматында талқылады, сондай-ақ жетекші фармацевтикалық компаниялардың, дистрибьюторлардың және дәріхана желілерінің топ-менеджерлерімен бір-бірден кездесулер өткізе алды.
«Proxima Research» компаниясының кәсіпқойлары әрқашан клиенттерге көмекке келеді, кез келген күрделіліктегі мамандандырылған маркетингтік зерттеулер жүргізеді және консультациялық қызметтер көрсетеді. Фармацевтикалық нарықтың болашағына көз жүгіртуге көмектеседі - тапсырыс берушінің қалауы бойынша олар әртүрлі макроэкономикалық көрсеткіштерді ескере отырып, нарықтық жағдайдың дамуы туралы қысқа, орта және ұзақ мерзімді болжамдар жасайды. Осындай қолдаудың арқасында фармкомпаниялар нарықтағы позицияларын жақсарта алады, әрдайым жағдайға ие болады және трендте болады.
Контакттер: https://proximaresearch.com/kz/ru/
E-mail:
Телефондар: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH
ФАРМАЦЕВТИЧЕСКИЕ РЫНКИ КАЗАХСТАНА И УЗБЕКИСТАНА
17–19 сентября в Ташкенте (Узбекистан) прошел Евразийский Фармацевтический Саммит 2024. Мероприятие организова�

17–19 сентября в Ташкенте (Узбекистан) прошел Евразийский Фармацевтический Саммит 2024. Мероприятие организовано компанией Global Pharmaceutical Leaders’ Club, а компания Proxima Research выступила в качестве аналитического партнера. Саммит собрал более 200 лидеров фармацевтической индустрии из стран Средней Азии, Кавказа и Восточной Европы, а также представителей органов власти, которые в ходе саммита обсудили ряд актуальных тем развития фармацевтических рынков Средней Азии.
ФАРМАЦЕВТИЧЕСКИЕ РЫНКИ КАЗАХСТАНА И УЗБЕКИСТАНА
Высокий интерес аудитории вызвал доклад Виталия Кима, директор Proxima Research Узбекистан, озвученный в ходе саммита. В нем он представил аналитическую информацию о развитии и структуре рынков Казахстана и Узбекистана.
По итогам І полугодия 2024 года, совокупный объем розничной реализации лекарственных средств и биологически активных добавок (БАД) на фармацевтических рынках Казахстана и Узбекистана составил около 1,8 млрд дол. США и увеличился на 16,6%, по сравнению с аналогичным периодом предыдущего года. В натуральном выражении объем продаж составил 596 млн упаковок и увеличился на 4,1% (рис. 1).
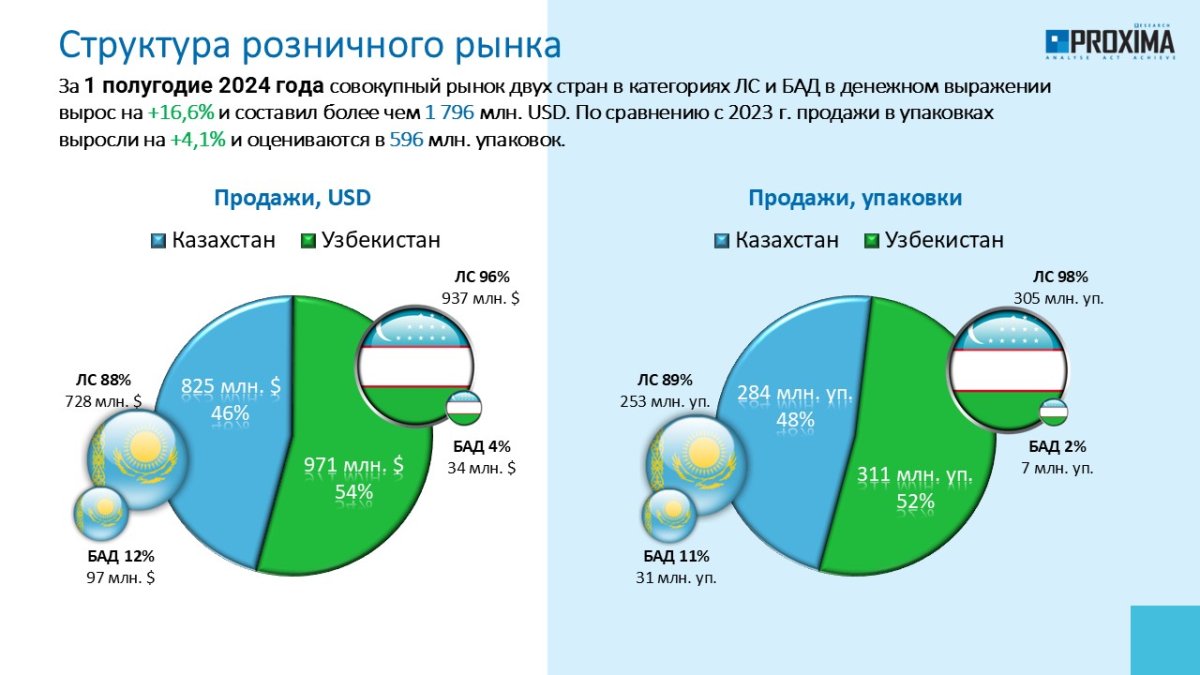
Рис. 1 Структура розничных продаж лекарственных средств и биологически активных добавок на рынках Казахстана и Узбекистана
Рассматривая структуру в разрезе категорий, можно отметить, что доля БАДов на рынке Узбекистана незначительна и составляет 4% в долларовом выражении и 2% - в натуральном. В то же время на рынке Казахстана доля БАДов достаточно весомая и составляет 12 и 11%, соответственно.
Проблема активного развития сегмента БАДов отмечается не только на рынках Средней Азии, но и на других развивающихся рынках, что связано с более простой регистрацией и меньшей зарегулированностью, в сравнении с лекарственными средствами.
Структура аптечных продаж препаратов отечественного и зарубежного производства свидетельствует о том, что фармрынки Казахстана и Узбекистана являются импортозависимыми. Доля импортных препаратов на рынке Казахстана, по итогам І полугодия 2024 года, составила 87% в денежном и 74% в натуральном выражениях. В Узбекистане эти показатели были равны 86% и 63%, соответственно (рис. 2). Также стоит отметить, что темпы прироста объемов продаж отечественных препаратов выше, чем для импортных. Это свидетельствует о том, что правительствами этих стран внедряются реформы и разрабатывают стратегии для локализации производств и снижения зависимости от импортных лекарств.
Анализируя структуру розничных продаж в разрезе рецептурного статуса, можно отметить достаточно высокую долю рецептурных препаратов на рынке Узбекистана. В Казахстане доля рецептурных препаратов ниже, однако динамика свидетельствует о более высоких темпах развития рецептурного сегмента, что будет способствовать увеличению его доли.
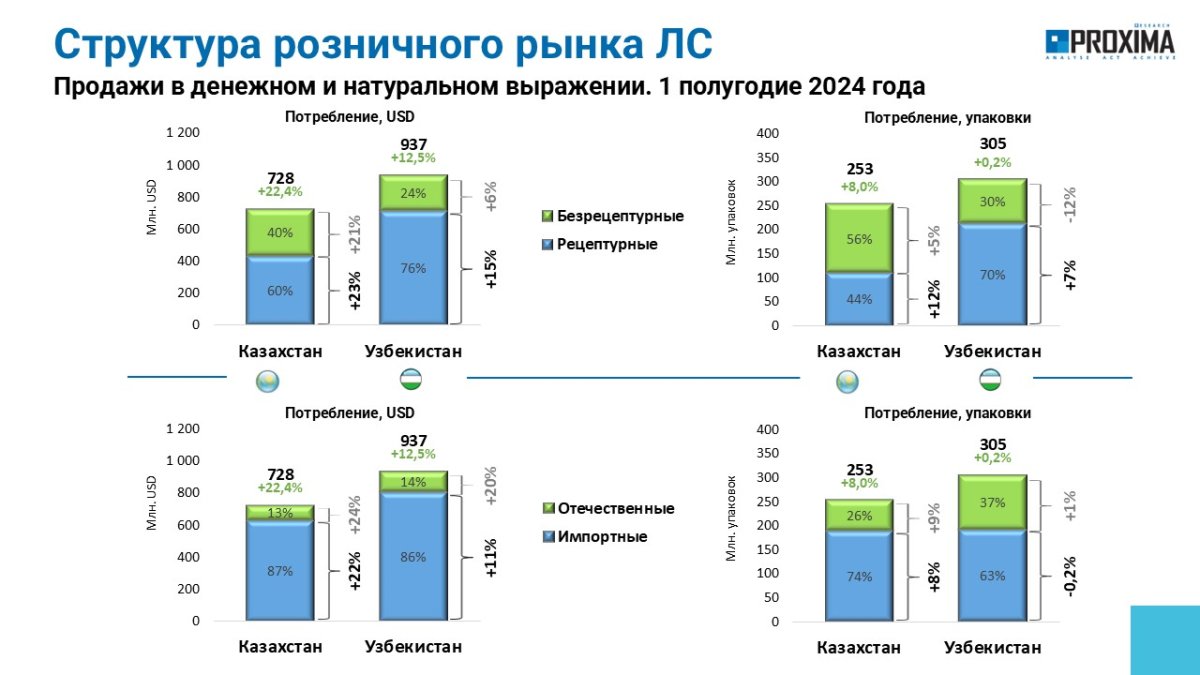
Рис. 2 Структура розничного рынка лекарственных средств Казахстана и Узбекистана в разрезе препаратов отечественного и зарубежного производства, а также их рецептурного статуса
С помощью индикаторов роста объема аптечных продаж лекарств можно понять за счет чего развиваются рынки. Как свидетельствуют данные, по итогам І полугодия 2024 г. рынок Казахстана в долларовом выражении демонстрировал рост преимущественно за счет индекса замещения, что свидетельствует о развитии путем увеличения физического потребления лекарств. В то же время на рынке Узбекистана одним из основных факторов роста является инфляционная составляющая, однако индекс замещения также вносит весомый вклад (рис. 3).
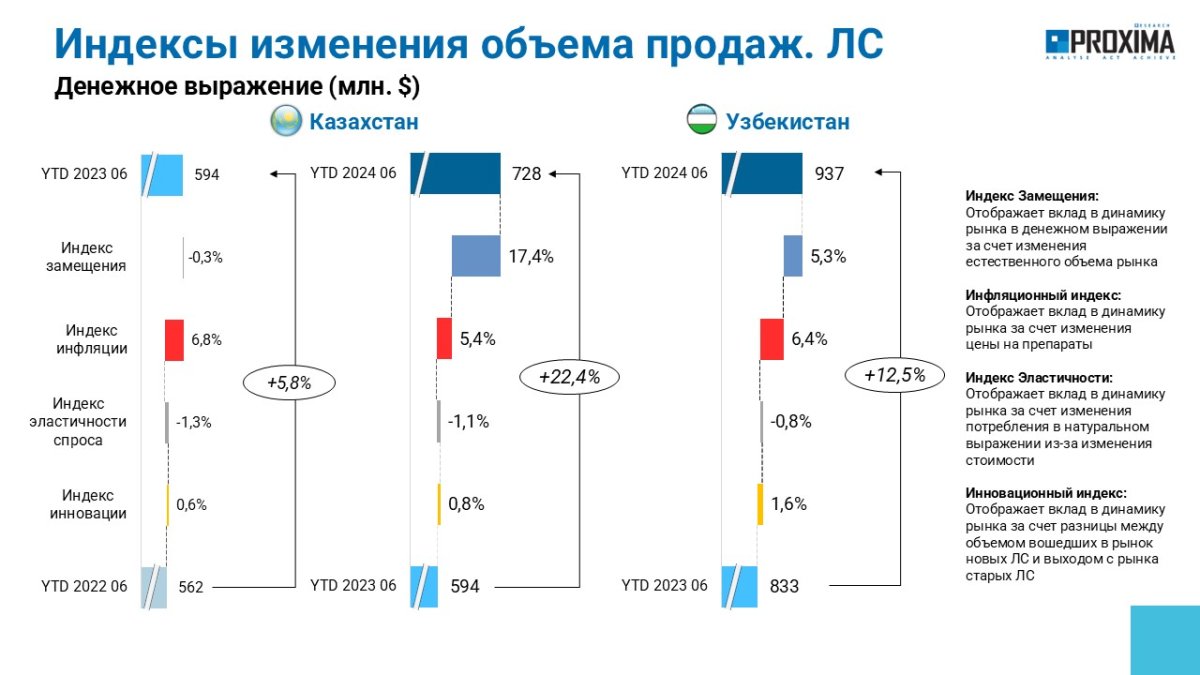
Рис. 3 Индикаторы изменения объема аптечных продаж лекарственных средств в долларовом выражении по итогам І полугодия 2024 г. по сравнению с аналогичным периодом 2023 г.
В І полугодии 2024 г. лидерами на рынке Казахстана среди маркетирующих организаций, по объему розничной реализации лекарственных средств в денежном выражении, являются компании «Штада-Нижфарм», «Санто» и «ВОРЛД МЕДИЦИН ГРУПП». В Узбекистане это компании – «КРКА», «Штада» и «Юрия-Фарм» (рис. 4). Как можно заметить в рейтинге много крупных международных компаний, что еще раз подтверждает высокую зависимости от импортных лекарств.
Среди брендов, лидерами по продажам в денежном выражении на рынке Казахстана являются СПИРТ ЭТИЛОВЫЙ, ГЕПТРАЛ и КРЕОН, а в Узбекистане - НАТРИЯ ХЛОРИД, ТИВОРТИН и РЕОСОРБИЛАКТ (рис. 5).
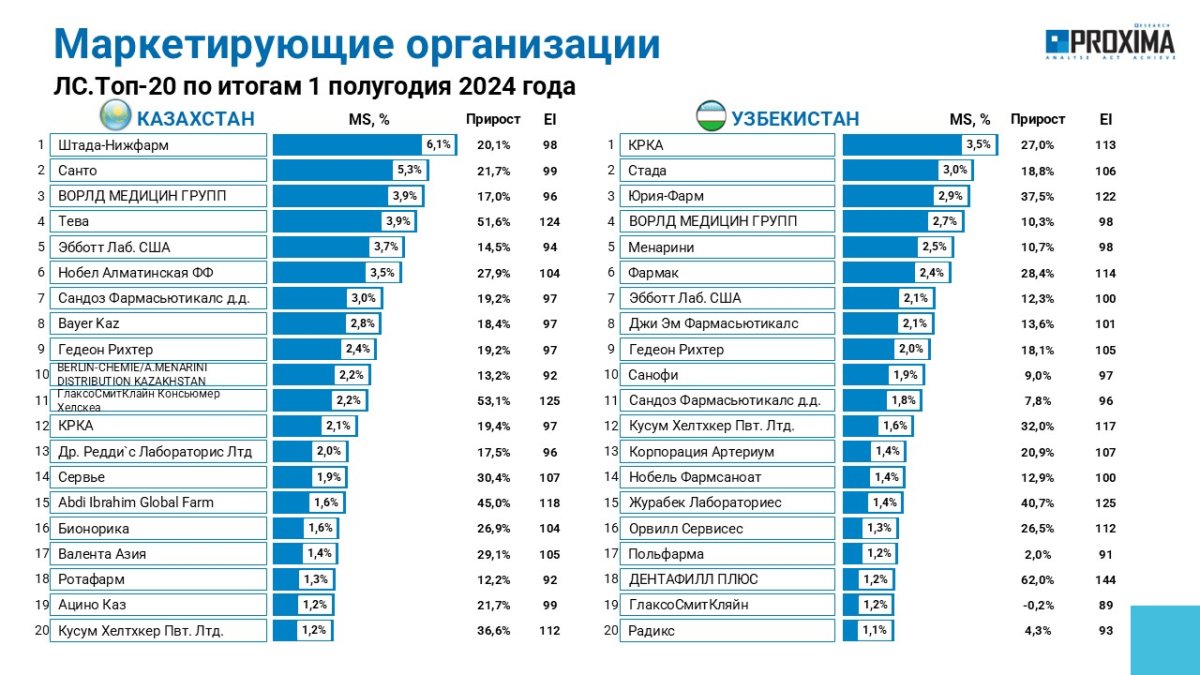
Рис. 4 Топ-20 Маркетирующих организаций по объему аптечных продаж лекарственных средств в денежном выражении по итогам I полугодия 2024 г. в Республиках Казахстан и Узбекистан
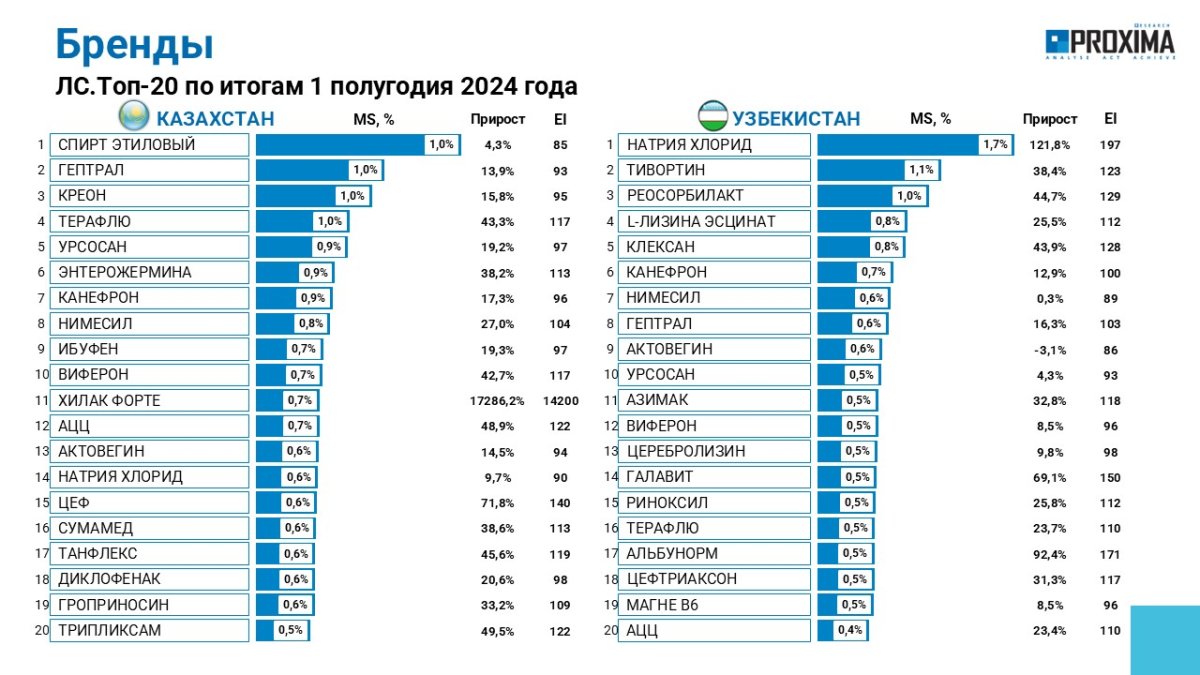
Рис. 5 Топ-20 брендов лекарственных средств по объему аптечных продаж в денежном выражении по итогам I полугодия 2024 г. в Республиках Казахстан и Узбекистан
ИТОГИ САММИТА
Фармацевтические рынки стран Средней Азии развиваются в условиях непрерывных вызовов и перемен. Данные свидетельствуют, что рынки Казахстана и Узбекистана активно развиваются, демонстрируя прирост розничных продаж, как в денежном, так и натуральном выражении. Положительная динамика рынков является позитивным сигналом для потенциальных инвесторов.
Евразийский Фармацевтический Саммит 2024 уже несколько лет подряд выступает платформой для обмена мнениями и совместной разработки стратегий, направленных на дальнейшее развитие фармацевтических рынков стран Евразии. Участники саммита активно обсуждали тенденции в государственном и коммерческом сегментах фармацевтических рынков таких стран, как Казахстан, Узбекистан, Кыргызстан, Азербайджан, Армения и другие. Одним из центральных вопросов стало будущее фармацевтических рынков в условиях растущих требований к качеству продукции и изменяющейся регуляторной базы.
Саммит предложил уникальные возможности для обмена опытом и обсуждения волнующих вопросов с ключевыми стейкхолдерами отрасли. В ходе мероприятия участники обсуждали интересующие вопросы в формате дискуссий и круглых столов с регуляторами, а также могли провести встречи один-на-один с топ-менеджерами ведущих фармацевтических компаний, дистрибьюторов и аптечных сетей.
Профессионалы компании «Proxima Research» всегда придут на помощь клиентам, проведут специализированные маркетинговые исследования любой сложности и окажут консультационные услуги. Помогут заглянуть в будущее фармацевтического рынка - по желанию заказчика сделают кратко-, средне- и долгосрочные прогнозы развития рыночной ситуации с учетом различных макроэкономических показателей. Благодаря такой поддержке фармкомпании смогут улучшать свои позиции на рынке, всегда владеть ситуацией и быть в тренде.
Контакты: https://proximaresearch.com/kz/ru/
E-mail:
Телефоны: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH
Во II квартале 2024 года организациями здравоохранения оказано услуг на 797 542,5 млн тенге
По данным Бюро национальной статистики Агентства по стратегическому планированию и реформам Республики Каз
По данным Бюро национальной статистики Агентства по стратегическому планированию и реформам Республики Казахстан, во II квартале 2024 года организациями здравоохранения было оказано услуг на 797 542,5 млн тенге, из которых 66,2% за счет бюджета, 14,5% - за счет средств предприятий, 19,3% - за счет средств, полученных от населения (таблица 1).
Наибольший объем услуг был сформирован за счет деятельности больничных организаций. Ими оказано услуг на сумму 434 369,6 млн тенге (51,7%). Организации, занимающиеся прочей деятельностью в области здравоохранения оказали услуги на сумму 142 432,2 млн тенге (17%) и организации, занимающиеся общей врачебной практикой - на сумму 126 260,7 млн тенге (15%).
Наименьшие объемы услуг по основному виду деятельности оказаны:
- организациями, занимающимися специальной врачебной практикой на сумму 48 426,3 млн тенге (5,8%),
- организациями, занимающимися стоматологической деятельностью - на сумму 46 273,8 млн тенге (5,5%).
По итогам II квартала 2024 года, 61,4% объема оказанных организациями здравоохранения услуг по основному виду деятельности предоставлены организациями государственной собственности, 36,1% - организациями частной собственности и 2,5% - организациями иностранной собственности.
В отчетном периоде объем оказанных услуг организациями здравоохранения, предоставленных крупными предприятиями составил 484 920,9 млн тенге (60,8%), малыми предприятиями – 200 011, 5 млн тенге (25,1%) и средними предприятиями – 112 610,0 млн тенге (14,1%).
Таблица 1
Объем оказанных услуг в области здравоохранения во II квартале 2024 года, тыс. тенге
|
За отчетный период |
В том числе, за счет | ||||||
| бюджета | населения | предприятий | |||||
| тыс. тенге | доля, % | тыс. тенге | доля, % | тыс. тенге | доля, % | ||
| Оказано услуг в области здравоохранения, всего | 797 542 434 | 528 148 375 | 66,2 | 153 802 004 | 19,3 | 115 592 055 | 14,5 |
| в том числе: | |||||||
| Услуги больниц | 382 824 419 | 302 733 092 | 79,1 | 36 720 247 | 9,6 | 43 371 080 | 11,3 |
| Услуги хирургических отделений больниц | 68 381 300 | 55 364 004 | 81,0 | 5 192 970 | 7,6 | 7 824 326 | 11,4 |
| Услуги гинекологических отделений больниц и родильных домов | 35 771 139 | 28 820 779 | 80,6 | 2 461 892 | 6,9 | 4 488 469 | 12,5 |
| Услуги центров реабилитации | 22 979 639 | 10 700 539 | 46,6 | 6 561 971 | 28,6 | 5 717 130 | 24,9 |
| Услуги психиатрических больниц | 13 857 952 | 13 037 208 | 94,1 | 785 676 | 5,7 | 35 068 | 0,3 |
| Услуги больниц предоставляемые под контролем врачей прочие | 29 477 481 | 25 443 487 | 86,3 | 1 741 733 | 5,9 | 2 292 261 | 7,8 |
| Услуги прочих больниц | 212 356 908 | 169 367 076 | 79,8 | 19 976 005 | 9,4 | 23 013 827 | 10,8 |
| Услуги в области врачебной практики общей | 167 985 579 | 117 043 856 | 69,7 | 29 654 784 | 17,7 | 21 286 938 | 12,7 |
| Услуги в области врачебной практики специализированной | 56 253 964 | 31 541 509 | 56,1 | 16 272 663 | 28,9 | 8 439 791 | 15,0 |
| Услуги в области стоматологии | 48 767 147 | 4 206 674 | 8,6 | 41 414 144 | 84,9 | 3 146 329 | 6,5 |
| Услуги по охране здоровья человека прочие | 141 711 326 | 72 623 244 | 51,2 | 29 740 165 | 21,0 | 39 347 916 | 27,8 |
Поквартальная динамика объема оказанных услуг в области здравоохранения, начиная с начала 2023 году представлена в таблице 2. Анализ этих сведений показывает, что объем в основном поступательно увеличивается. Причем в прошлом году рост наблюдался по всем источникам - как за счет средств бюджета, так и за счет денег населения. Примечательно, что в предыдущем году он достиг своего максимума в последнем квартале года, и это, несмотря на то, что повсеместно звучали жалобы на проблемы с доступом к медицинским услугам - откладывались диагностические и терапевтические процедуры со ссылкой на отсутствие денег в бюджете.
Интересно, что по сравнению с I кварталом текущего года, во II квартале этого же самого года отмечалось резкое увеличение объема услуг, оплаченных населением. Прирост составил 20,3% (в тенге - на 25 972 млн). Главными драйверами наблюдаемого скачка стали расходы населения на:
- услуги в области стоматологии (+26,4% - на 8 655 млн тенге),
- услуги по охране здоровья человека (+23,9% - на 5 737 млн тенге),
- услуги в области общей врачебной практики (20% - на 4 934 млн тенге),
- услуги прочих больниц (27,9% - на 4 356 млн тенге),
- услуги центров реабилитации (+84,4% - на 3 004 млн тенге).
Таблица 2
Объем оказанных услуг в области здравоохранения с I по IV квартал 2023 года и I-II кв. 2024 года, тыс. тенге
| Период |
Оказано услуг
в области
здравоохранения,
всего
|
в том числе за счет средств | ||
| бюджета | населения | предприятий | ||
| I квартал 2023 года | 688 476 151 | 528 940 690 | 108 496 912 | 51 038 549 |
| II квартал 2023 года | 755 725 432 | 573 427 736 | 111 801 946 | 70 495 750 |
| III квартал 2023 года | 737 928 811 | 541 919 484 | 127 869 478 | 68 139 849 |
| IV квартал 2023 года | 892 719 849 | 679 677 254 | 133 894 205 | 79 148 390 |
| Всего в 2023 году | 3 025 397 583 | 2 323 965 164 | 482 062 541 | 268 822 538 |
| I квартал 2024 года | 719 830 751 | 454 283 465 | 127 829 800 | 137 717 486 |
| II квартал 2024 года | 797 542 434 | 528 148 375 | 153 802 004 | 115 592 055 |
Напомним, что под объёмом оказанных услуг понимается стоимость услуг, оказанных организациями здравоохранения, в размере средств, которые поступают от предприятий, организаций и (или) непосредственно от населения (домашних хозяйств) в уплату за оказанные им услуги и оцениваются как доход организации, который, в свою очередь оценивается по стоимости реализации, полученной или причитающейся к получению.
Основной вид деятельности - вид деятельности, добавленная стоимость которого превышает добавленную стоимость любого другого вида деятельности, осуществляемого хозяйствующим субъектом.
Вторичный вид деятельности вид деятельности, помимо основного, который осуществляется с целью производства продукции (товаров и услуг) для третьих лиц.
Для справки, категория услуг по охране здоровья человека (КПВЭД - 86.90.1) включает: услуги, оказываемые во время беременности, услуги медсестер, услуги физиотерапевтов, услуги скорой и неотложной медицинской помощи, услуги медицинских лабораторий, услуги банков крови, банков спермы, банков органов для трансплантации, услуги диагностические без расшифровки результатов, услуги по психотерапии и психоанализу, услуги по охране здоровья человека прочие, не включенные в другие группировки.
2024 ЖЫЛДЫҢ І ЖАРТЫЖЫЛДЫҒЫНЫҢ ҚОРЫТЫНДЫСЫ БОЙЫНША ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ФАРМНАРЫҒЫНА ШОЛУ
Экономикалық даму фармацевтикалық нарықты дамытудың негізгі аспектілерінің бірі болып табылады. Өйткені, э�

Экономикалық даму фармацевтикалық нарықты дамытудың негізгі аспектілерінің бірі болып табылады. Өйткені, экономиканың өсуі денсаулық сақтау жүйесін қаржыландыруды және тиісінше медициналық тауарларды сатып алуды ұлғайтуға мүмкіндік береді. Сонымен қатар, халықтың әл-ауқатының жақсаруы бөлшек сауда сегментінің дамуына оң әсер етеді. Қазақстан экономикасы дамуын жалғастыруда, Қазақстан Республикасы Стратегиялық жоспарлау және реформалар агенттігінің Ұлттық статистика бюросының алдын ала деректері бойынша 2024 жылғы І тоқсанда ЖІӨ өсімі 3,8%-ды құрады. ЖІӨ-нің өсу қарқыны 2023 жылмен салыстырғанда біршама баяулады, бірақ айтарлықтай жоғары болып қала береді. Инфляция төмендеуін жалғастыруда және 2024 жылдың маусымында 8,4%-ды құрады. Сондай-ақ, халықтың табысының біртіндеп өсуін атап өткен жөн. 2024 жылдың басынан бастап АҚШ долларының бағамы кезең-кезеңімен төмендеді, алайда маусым айынан бастап Ұлттық валютаның әлсіреу үрдісі байқалды. Бұл басылымда Қазақстан Республикасы фармарынкасының негізгі көрсеткіштері көрсетілген. Материалды дайындау кезінде «Proxima Research International» компаниясының «PharmXplorer» нарықты зерттеудің аналитикалық жүйесінің Sell Out деректері пайдаланылды.
БӨЛШЕК САУДА НАРЫҒЫНЫҢ ЖАЛПЫ ТЕНДЕНЦИЯЛАРЫ ЖӘНЕ НЕГІЗГІ ОЙЫНШЫЛАР
Экономиканың өсуі фармацевтикалық нарықтың дамуына ықпал етеді. 2024 жылдың І жартыжылдығының қорытындысы бойынша «дәріхана себетінің» барлық санаттағы тауарларын бөлшек саудада өткізудің жалпы көлемі 425,1 млрд теңгені құрады және өткен жылдың сәйкес кезеңімен салыстырғанда 24% - ға ұлғайды. Қаптамада сату көлемі 11%-ға артып, 396,2 млн қаптаманы құрады. Дәрілік заттар нарығы да жоғары қарқынмен дамып келеді. Зерттелетін кезеңде дәрілік заттарды дәріханалық сату көлемі 326,5 млн теңгені және 253,0 млн қаптаманы құрайды, ал динамика көрсеткіштері тиісінше +22%-ды және +8%-ды құрайды (1-сурет).
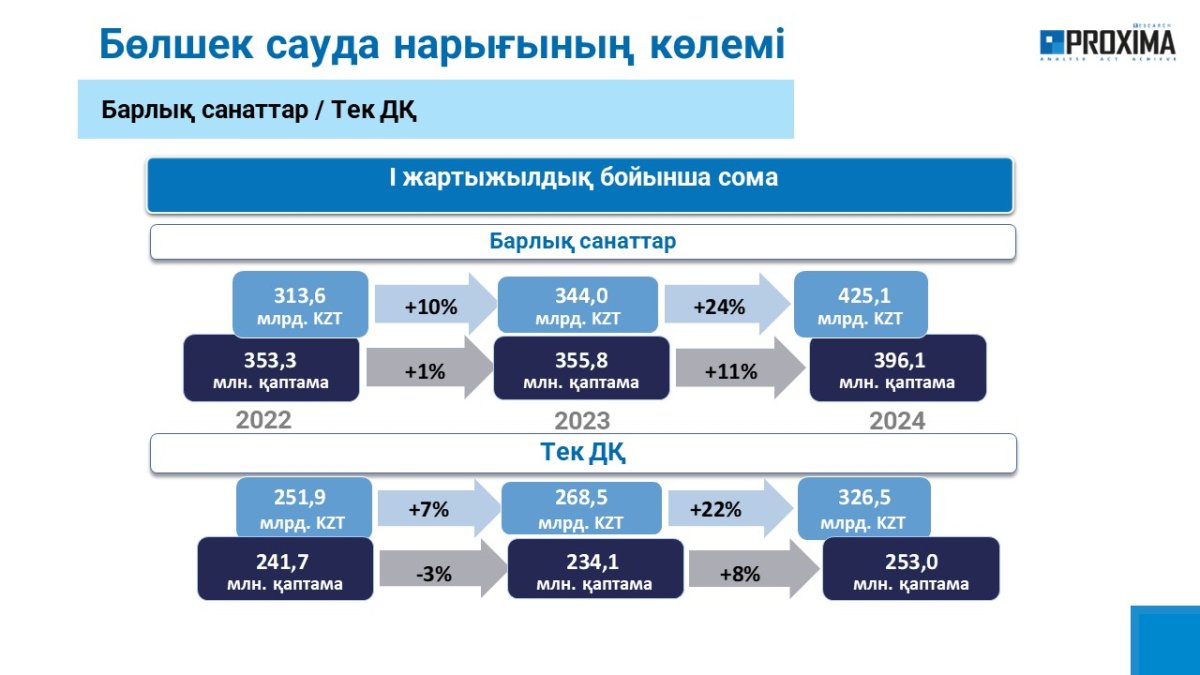 1-сурет. Өткен жылдың ұқсас кезеңімен салыстырғанда өсу/төмендеу қарқынын көрсете отырып, 2022-2024 жж.І жартыжылдығының қорытындылары бойынша «дәріхана себетінің» тауарларын және жеке дәрілік заттарды ақшалай және заттай мәнде бөлшек саудада өткізу көлемі
1-сурет. Өткен жылдың ұқсас кезеңімен салыстырғанда өсу/төмендеу қарқынын көрсете отырып, 2022-2024 жж.І жартыжылдығының қорытындылары бойынша «дәріхана себетінің» тауарларын және жеке дәрілік заттарды ақшалай және заттай мәнде бөлшек саудада өткізу көлемі
2024 жылы нарықтың ақшалай түрдегі дамуы негізінен физикалық тұтынудың өсуіне байланысты, мұны алмастыру индексінің жоғары көрсеткіштері дәлелдейді. 2023 жылы нарық негізінен инфляциялық құрастырушысымен дамыды (2-сурет).
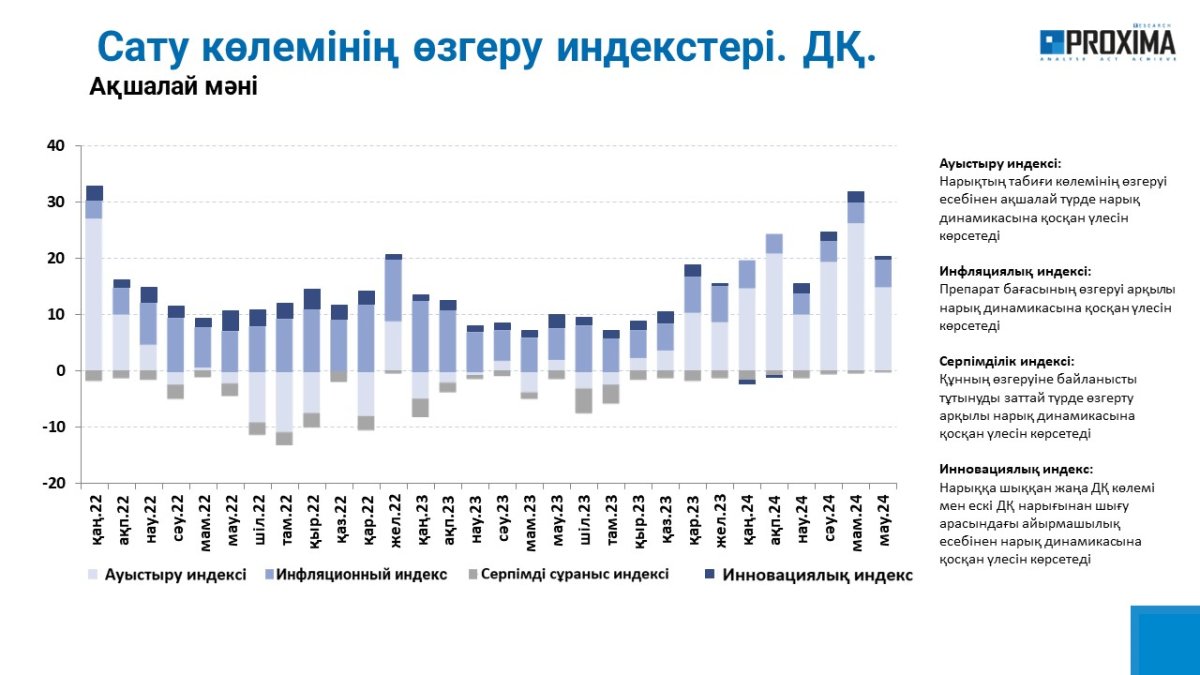 2-сурет Өткен жылдың сәйкес кезеңімен салыстырғанда 2022 жылғы қаңтардан 2024 жылғы маусымға дейінгі кезеңде дәрілік заттарды дәріханалық сату көлемінің ақшалай мәнде өзгеру индикаторлары
2-сурет Өткен жылдың сәйкес кезеңімен салыстырғанда 2022 жылғы қаңтардан 2024 жылғы маусымға дейінгі кезеңде дәрілік заттарды дәріханалық сату көлемінің ақшалай мәнде өзгеру индикаторлары
2024 жылғы маусымда «дәріхана себетінің» 1 қаптамасының орташа өлшенген құны 2023 жылғы маусыммен салыстырғанда 6%-ға өсті. Санаттар бойынша орташа өлшенген құнның ең үлкен өсуі дәрілік заттар мен медициналық мақсаттағы бұйымдар үшін белгіленеді (3-сурет). Дегенмен, орташа өлшенген құнның өсуі бағаның өсуін ғана емес, сонымен қатар тұтынуды қымбатырақ препараттарға қайта бөлуді де көрсететінін түсіну маңызды.
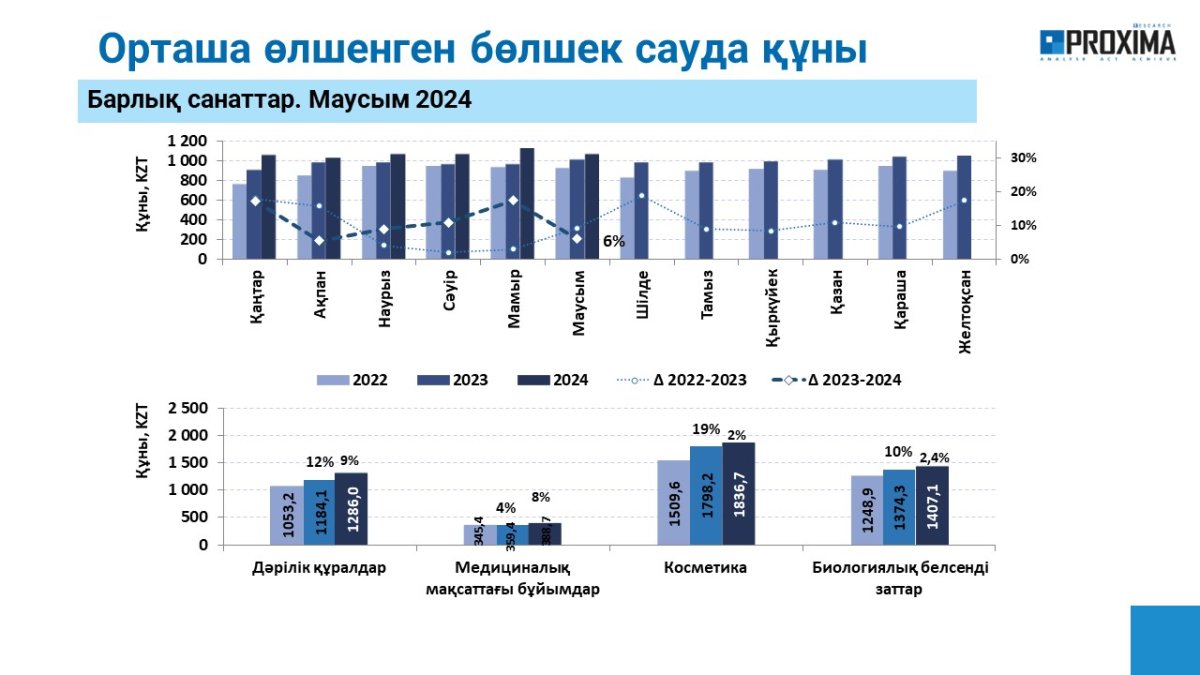
3-сурет Өткен жылдың сәйкес кезеңімен салыстырғанда өсу/төмендеу қарқынын көрсете отырып, 2024 жылғы маусым қорытындысы бойынша «дәріхана себеті» тауарларының әртүрлі санаттарының 1 қаптамасының орташа өлшенген құнының динамикасы
Қазақстанның фармацевтикалық нарығы негізінен импортқа тәуелді, алайда отандық препараттардың үлесі біртіндеп артып келеді. МАТ көрсеткіші бойынша 2024 жылғы маусымда отандық препараттардың үлесі ақшалай мәнде 13%-ды табиғи және заттай мәнде 25%-ды құрады (4-сурет).
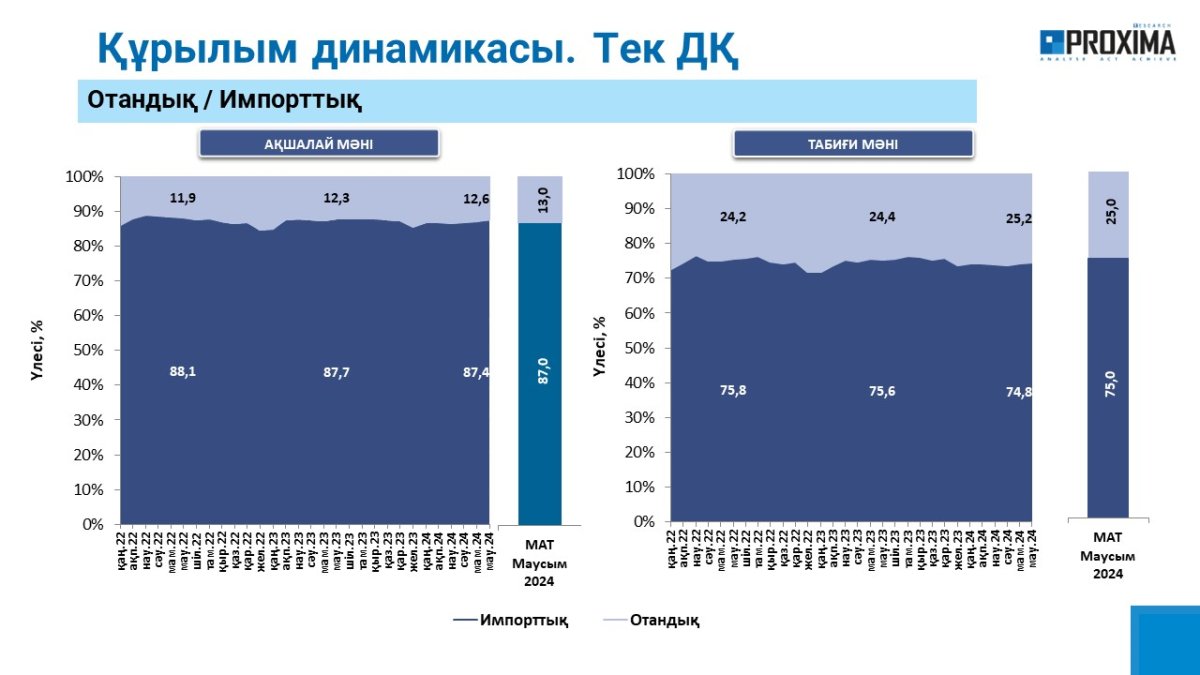
4-сурет 2022 жылғы қаңтардан бастап 2024 жылғы маусымға дейін ақшалай және заттай мәнде отандық және шетелдік өндірілген дәрілік заттарды дәріханалық сатудың құрылымы
2024 жылдың І жартыжылдығында дәрілік заттарды ақшалай түрде дәріханалық сату көлемі бойынша көшбасшылар «Штада-Нижфарм», «Санто» және «ВОРЛД МЕДИЦИН ГРУПП» компаниялары болды. Сонымен қатар, топ-10 компанияларының көпшілігі 2022 жылдың сәйкес кезеңімен салыстырғанда нарықтағы үлесін арттыра алды. Брендтер арасында ГЕПТРАЛ, КРЕОН және ТЕРАФЛЮ (5-сурет).
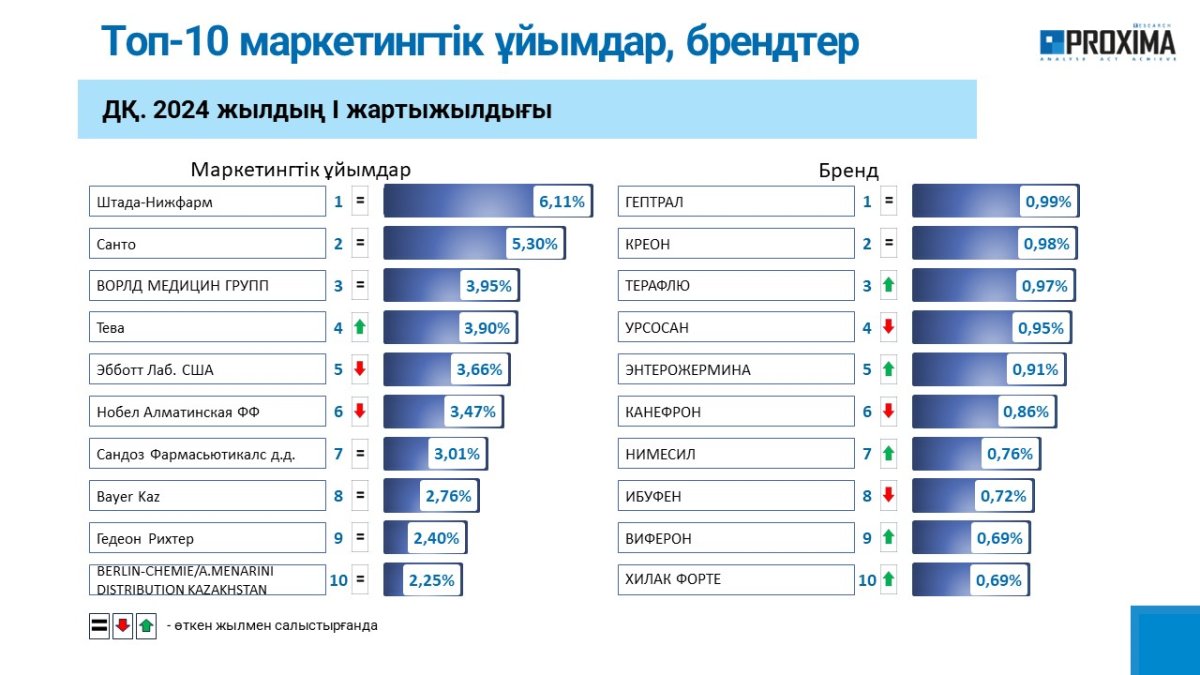
5-сурет. 2024 жылғы І жартыжылдықтың қорытындысы бойынша ақшалай мәнде бөлшек саудада өткізу көлемі бойынша Топ-10 маркетингтік ұйымдар мен дәрілік заттар брендтері
Биологиялық белсенді қоспалар (ББҚ) сегментінде бөлшек сауда көлемі бойынша көшбасшылар «Эвалар», «ВОРЛД МЕДИЦИН ГРУПП» және «Юнифарм Инк» компаниялары болып табылады. Ал ең көп сатылатын брендтер – ДЕТРИМАКС, ФЕРТАЛЬ және ФЕМИБИОН (6-сурет).
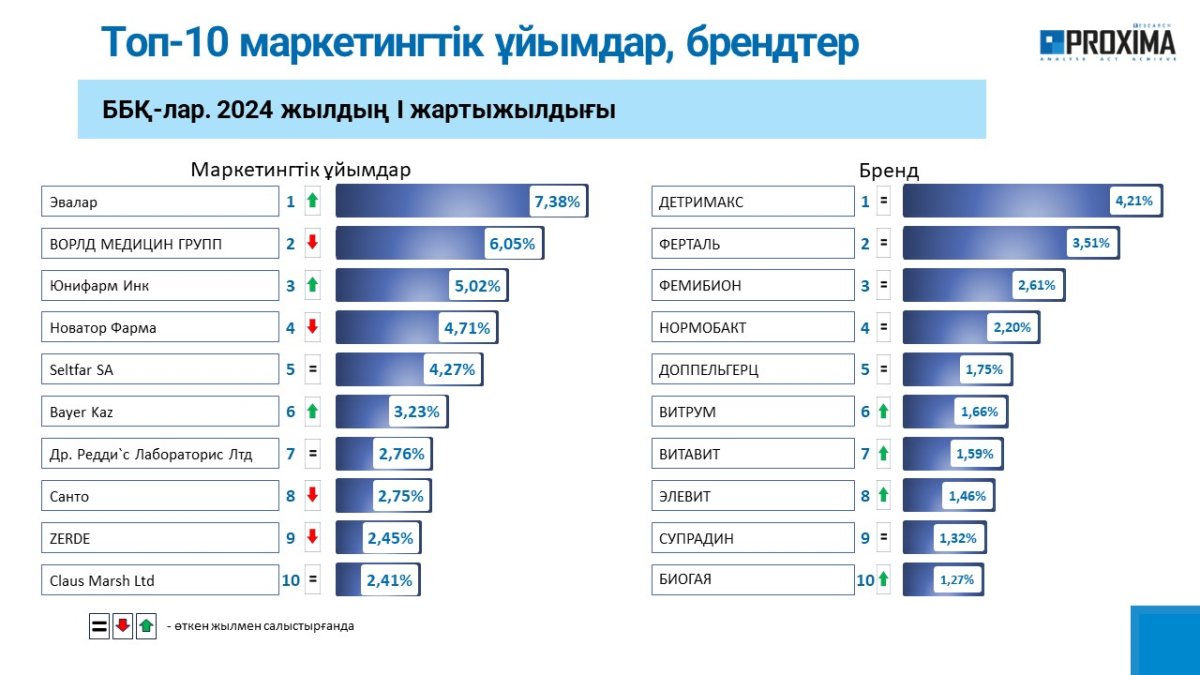
6-сурет. 2024 жылғы I жартыжылдықтың қорытындысы бойынша бөлшек саудада сату көлемі бойынша топ-10 маркетингтік ұйымдар мен ББҚ брендтері ақшалай мәнде
ДӘРІХАНАЛАР
2024 жылдың І жартыжылдығының қорытындысы бойынша «БИОСФЕРА», «ЗЕРДЕ-ФАРМА» және «РАУЗА-АДЕ» (7-сурет). 2024 жылдың маусымындағы жағдай бойынша ең үлкен дәріхана желісі 382 дәріханаға иелік етеді және жалпы айналымның 7,35% жинайды. Өңірлер бөлінісінде 2024 жылғы қаңтар-маусым кезеңіндегі дәріхана желілерінің орташа айлық тауар айналымы бойынша көшбасшылар Алматы, Астана және Шымкент қалалары болып табылады (8-сурет).

7-сурет. 2024 жылдың І жартыжылдығының қорытындысы бойынша тауар айналымы бойынша топ-10 дәріхана желісі
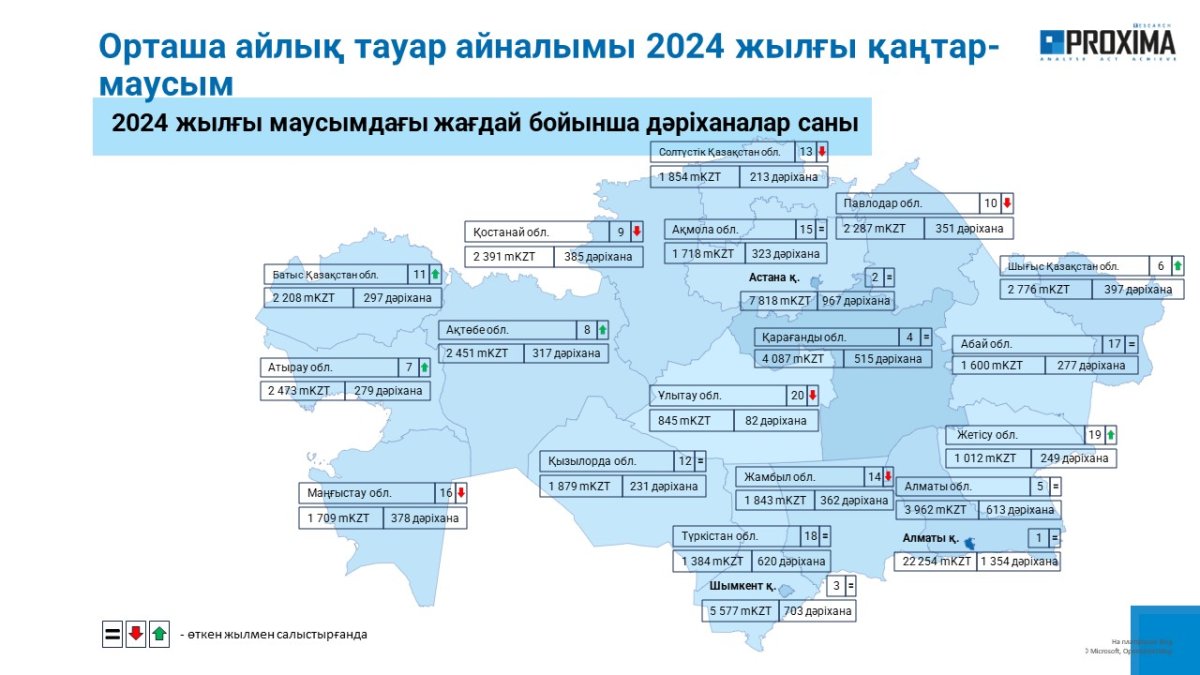
8-сурет. Аймақтар бойынша дәріханалардың орташа айлық айналымы 2024 жылғы қаңтар-маусым және дәріханалар саны 2024 жылғы маусымдағы жағдай бойынша
АУРУХАНА СЕГМЕНТІ
Госпитальдық сегментінде ақшалай тұтынудың өсуі де тіркеледі. 2024 жылдың I жартыжылдығында ұлттық валютадағы дәрі-дәрмектерді тұтыну өткен жылдың сәйкес кезеңімен салыстырғанда 23,5%-ға өсті. Сонымен қатар, тұтыну табиғи түрде 11,6%-ға төмендеді, бұл қымбатырақ препараттарды сатып алуды көрсетуі мүмкін (9-сурет).
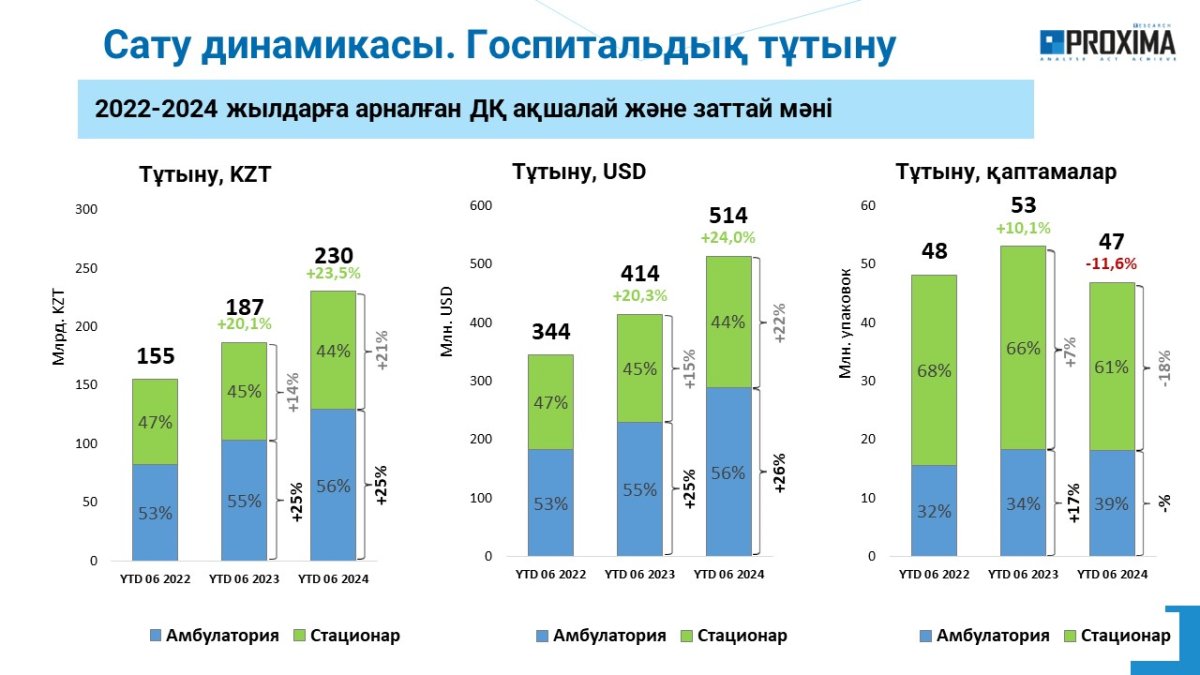
9-сурет 2022-2024 жж. І жартыжылдығының қорытындысы бойынша дәрілік заттарды госпитальдық тұтыну динамикасы
ҚОРЫТЫНДЫЛАР МЕН БОЛЖАМДАР
Қазақстан Республикасының макроэкономикалық көрсеткіштері жақсаруда. 2024 жылдың I жартыжылдығының қорытындысы бойынша фармацевтикалық нарық ақшалай да, заттай да айтарлықтай жоғары өсу қарқынын көрсетеді. 2024 жылдың II жартыжылдығында сарапшылар дәрі-дәрмектерді бөлшек саудада сатудың баяулауын, тіпті олардың құлдырауын күтеді. Алайда, 2024 жылдың қорытындысы бойынша дәрілік заттарды бөлшек саудада өткізу нарығының базалық сценарий бойынша шамамен 10%-ға өсуі күтілуде (10-сурет).
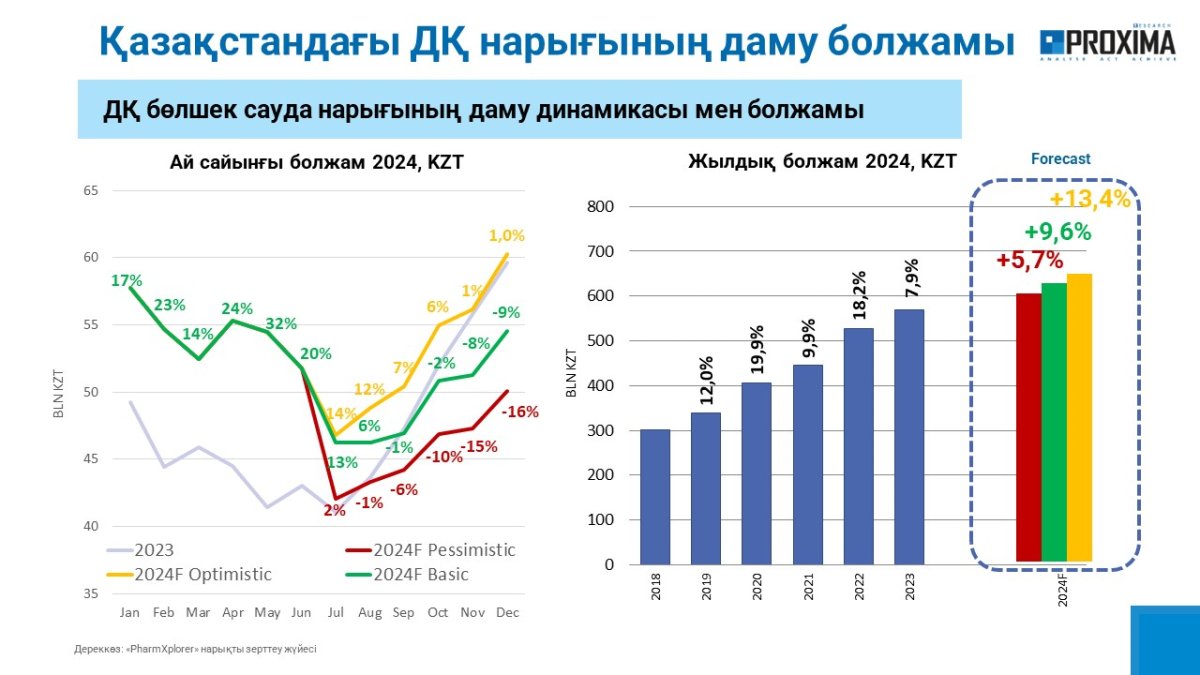
10-сурет Қазақстан Республикасының дәрілік заттар нарығын ұлттық валютада дамыту болжамы.
«Proxima Research» компаниясының кәсіпқойлары әрқашан клиенттерге көмекке келеді, кез келген күрделіліктегі мамандандырылған маркетингтік зерттеулер жүргізеді және консультациялық қызметтер көрсетеді. Фармацевтикалық нарықтың болашағына көз жүгіртуге көмектеседі - тапсырыс берушінің қалауы бойынша олар әртүрлі макроэкономикалық көрсеткіштерді ескере отырып, нарықтық жағдайдың дамуы туралы қысқа, орта және ұзақ мерзімді болжамдар жасайды. Осындай қолдаудың арқасында фармкомпаниялар нарықтағы позицияларын жақсарта алады, әрдайым жағдайға ие болады және трендте болады.
Контакттер: https://proximaresearch.com/kz/ru/
E-mail:
Телефондар: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH
Производство фармацевтической продукции в РК в I полугодии 2024 года
По данным Бюро национальной статистики Агентства по стратегическому планированию и реформам Республики Каз
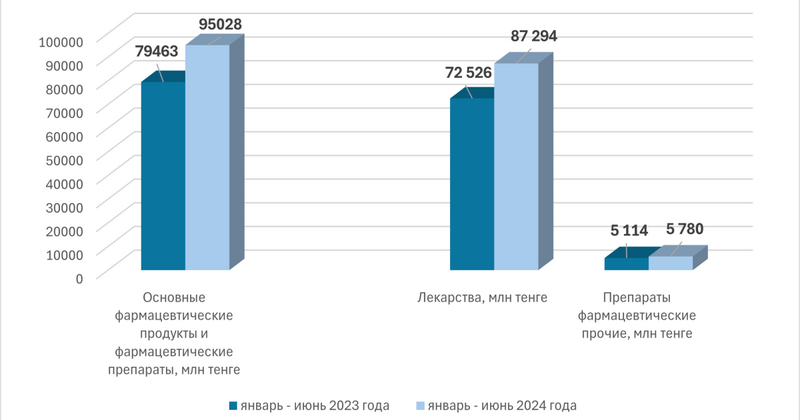
По данным Бюро национальной статистики Агентства по стратегическому планированию и реформам Республики Казахстан, по итогам I-го полугодия 2024 года объем производства основных фармацевтических продуктов и фармацевтических препаратов составил 95 028 млн тенге, что на 14,8% больше, чем в аналогичном периоде 2023 года.
При этом лекарственных средств было произведено на 87 294 млн тенге, а препаратов фармацевтических прочих на 5 780 млн тенге, что на 20,4% и 13% больше, чем в I-е полугодии 2023 года, соответственно (рисунок 1). В натуральном выражении объем производства лекарств увеличился на 10,5% с 17,9 тонн в I полугодии 2023 года до 19,8 тонн в I полугодии 2024 года.
Рисунок 1
Объем производства фармацевтической продукции в стоимостном выражении в I полугодии 2024 года, млн тенге
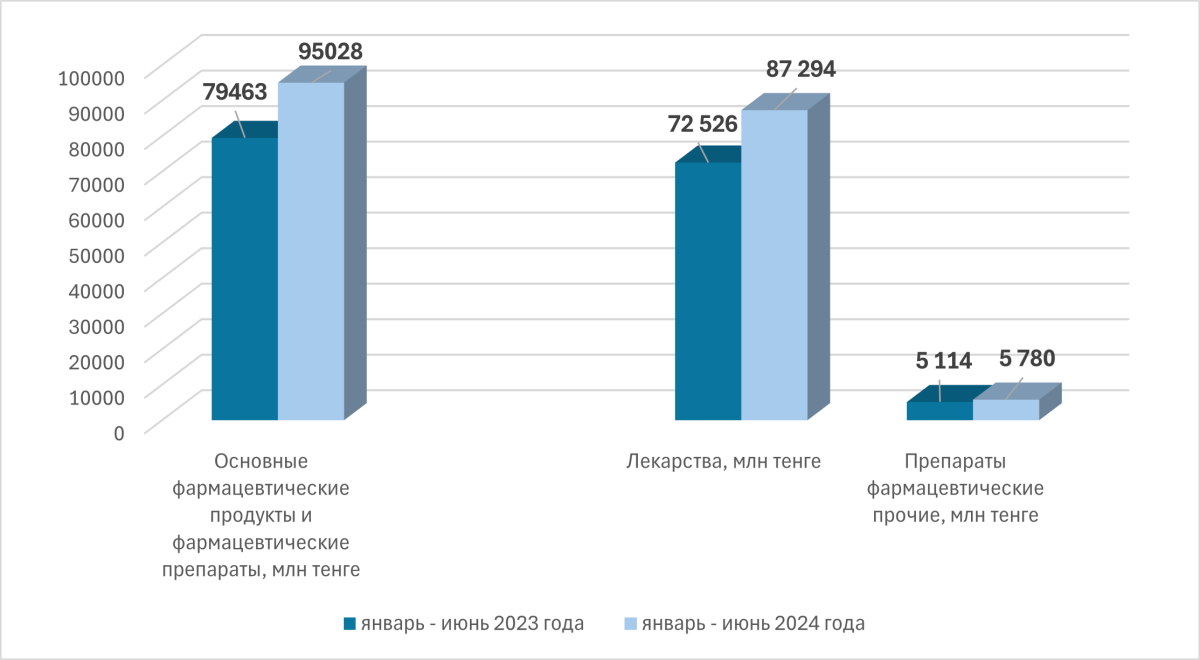
Главным образом, фармацевтическая промышленность в Казахстане локализована в четырех регионах - гг. Шымкент, Алматы, Алматинской и Карагандинской областях. Их вклад в общий объем фармпроизводства по итогам I полугодия 2024 года составил порядка 96% (рисунок 2).
Рисунок 2
Объем производства фармацевтической продукции в стоимостном выражении в разрезе регионов РК в I полугодии 2024 года
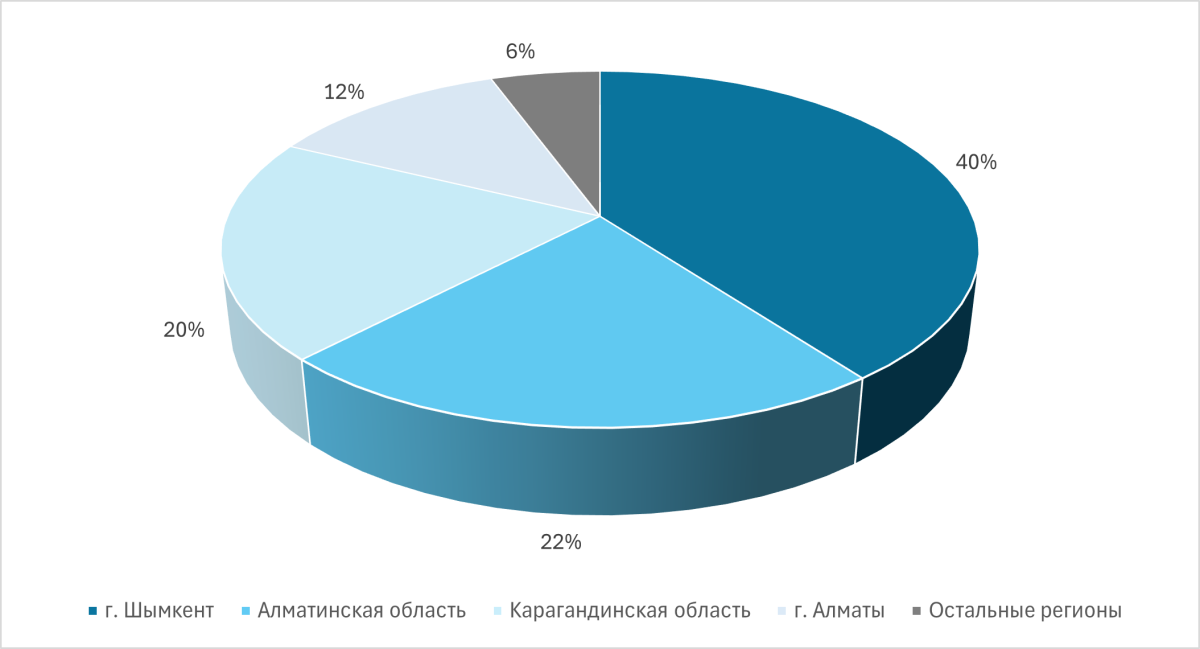
При этом среди регионов наибольший рост в стоимостном выражении в течение анализируемого периода зафиксирован в Шымкенте, Алматинской и Карагандинской области (рисунок 3, таблица 1). В этих регионах локализованы крупнейшие казахстанские фармпредприятия - АО «Химфарм», Карагандинский фармацевтический комплекс и другие.
Рисунок 3
Динамика объема производства фармацевтической продукции в стоимостном выражении в разрезе регионов в I полугодии 2023 и 2024 годов
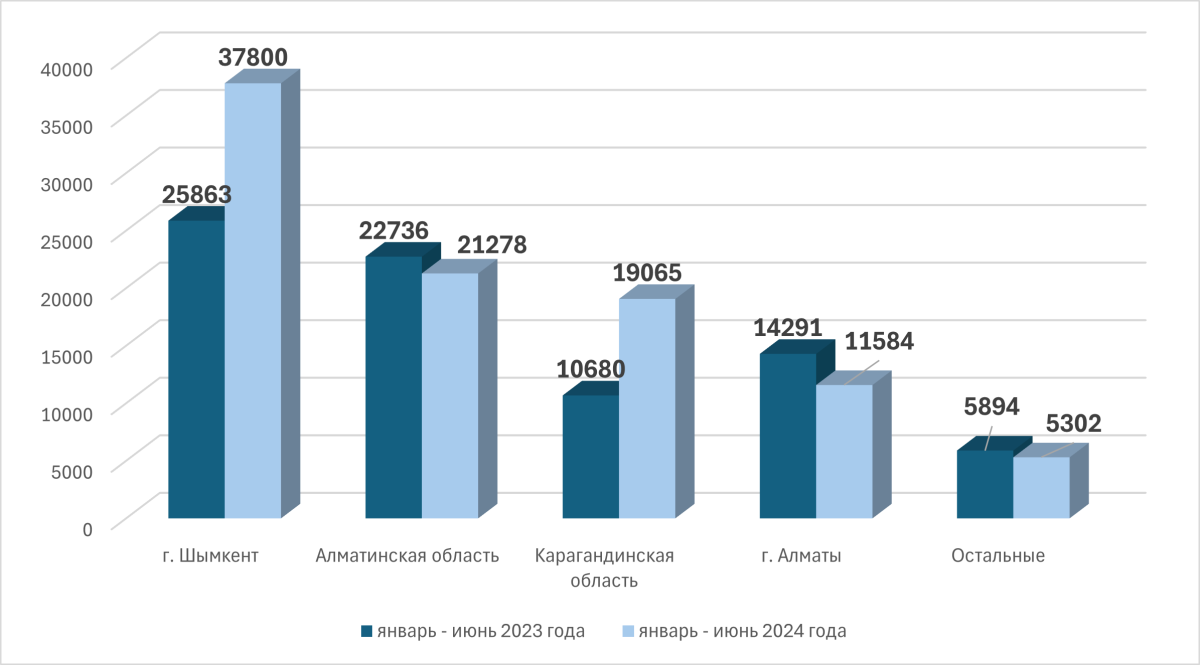
Таблица 1
Динамика объема производства фармацевтической продукции в стоимостном выражении в разрезе регионов в I полугодии 2023 и 2024 годов
| Регион | Период | |
| январь - июнь 2023 года | январь - июнь 2024 года | |
| Республика Казахстан | 79463,113 | 95027,993 |
| Акмолинская область | 149,075 | 58,057 |
| Кокшетау г.а. | 0,342 | |
| Степногорск г.а. | 130,365 | 30,071 |
| Шортандинский район | 18,368 | 27,986 |
| Актюбинская область | 1614,594 | 1456,031 |
| Актобе г.а. | 1614,594 | 1456,031 |
| Алматинская область | 22735,598 | 21277,637 |
| Қонаев г.а. | 0,856 | |
| Енбекшиказахский район | 372,327 | 790,104 |
| Карасайский район | 9448,283 | 11534,297 |
| Райымбекский район | 0,102 | 0,102 |
| Талгарский район | 382,529 | 483,833 |
| Илийский район | 12531,5 | 8469,301 |
| Жамбылская область | 1927,146 | 1709,833 |
| Тараз г.а. | 67,693 | 539,918 |
| Кордайский район | 1859,454 | 1169,915 |
| Карагандинская область | 10679,986 | 19064,741 |
| Караганда г.а. | 10671,27 | 19053,109 |
| Балхаш г.а. | 8,716 | 11,633 |
| Костанайская область | 64,436 | 70,052 |
| Костанай г.а. | 64,436 | 70,052 |
| Мангистауская область | 124,93 | 182,465 |
| Актау г.а. | 124,93 | 182,465 |
| Павлодарская область | 562,1 | 431,921 |
| Павлодар г.а. | 562,1 | 431,921 |
| Северо-казахстанская область | 18,961 | 4,33 |
| Петропавловск г.а. | 18,961 | 4,33 |
| Восточно-казахстанская область | 619,646 | 658,232 |
| Усть-Каменогорск г.а. | 581,386 | 603,524 |
| Глубоковский район | 1,23 | 2,076 |
| Катон-Карагайский район | 37,03 | 52,632 |
| г. Астана | 67,72 | 15,974 |
| Район Алматы | 67,72 | 15,974 |
| г. Алматы | 14290,675 | 11583,999 |
| Алмалинский район | 7437,956 | 5664,995 |
| Ауэзовский район | 27,342 | 10,604 |
| Бостандыкский район | 133,964 | 82,625 |
| Жетысуский район | 4679,176 | 3687,521 |
| Медеуский район | 456,792 | 594,286 |
| Турксибский район | 1555,446 | 1543,969 |
| Шымкент г.а. | 25863,327 | 37800,11 |
| Абайский район | 218,732 | |
| Каратауский район | 364,249 | 65,384 |
| Енбекшинский район | 3,207 | 1,603 |
| Аль-Фарабийский район | 25495,872 | 37514,39 |
| Туркестанская область | 137,594 | 135,25 |
| Ордабасынский район | 137,594 | 135,25 |
| Область Жетісу | 164,779 | 70,301 |
| Талдыкорган г.а. | 12,685 | 12,416 |
| Сарканский район | 152,094 | 57,885 |
| Область Абай | 442,543 | 509,061 |
| Семей г.а. | 442,543 | 509,061 |
Напомним, развитию фармацевтического производства в настоящее время уделяется пристальное внимание. Так, одним из направлений Национального плана развития Республики Казахстан до 2029 года, утвержденного Указом Президента Республики Казахстан от 30 июля 2024 года №611, является развитие фарминдустрии. В документе отмечается, что в стране фармацевтическая отрасль имеет слабое развитие: в 2023 году доля лекарственных средств и медицинских изделий отечественного производства на локальном фармацевтическом рынке составила всего 14,4%, а доля казахстанской отечественной продукции в быстрорастущих объемах закупа лекарственных средств - всего 32%. Поэтому в целях развития отечественного производства лекарственных средств и повышения их доступности будут приняты меры по расширению сотрудничества с глобальными фармацевтическими корпорациями, привлечению инвестиций, трансферта технологий и новейших разработок, а также локализации производства лекарственных средств.
В целом, отрасль имеет огромный потенциал. Однако для ее развития необходимы долгосрочные благоприятные и адекватные условия. Производство лекарственных средств и другой медицинской продукции относится к наукоемким областям и требует огромных долгосрочных вложений, ведь процесс создания производственной площадки и вывода такой продукции на рынок крайне сложен, затратен и продолжителен. Здесь важно все: политическая стабильность, торговые отношения страны с другими государствами, состояние системы здравоохранения, наличие инфраструктуры, логистических путей, кадров, льгот и преференций для фармпроизводителей, а также то, насколько они доступны и как работают на практике. Ну, и самое главное, чтобы слова подкреплялись реальными действиями, а все государственные ведомства действовали в верном направлении, выгодным для отрасли и ее развития.
Топ-10 аптечных сетей Казахстана по товарообороту по итогам I полугодия 2024 года
По данным Sell Out аналитической системы исследования рынка «PharmXplorer» компании «Proxima Research International», по итогам I
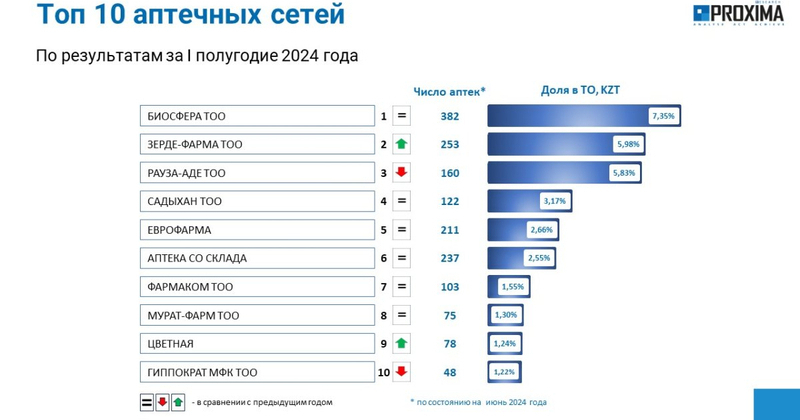
По данным Sell Out аналитической системы исследования рынка «PharmXplorer» компании «Proxima Research International», по итогам I полугодия 2024 г., общий объем розничной реализации всех категорий товаров «аптечной корзины» составил 425,1 млрд тенге, что на 24% больше, по сравнению с аналогичным периодом предыдущего года. В натуральном выражении объем продаж увеличился на 11% и составил 396,2 млн упаковок. Рынок лекарственных средств также развивается высокими темпами. В исследуемый период объем аптечных продаж лекарственных средств составил 326,5 млн тенге и 253,0 млн упаковок, а показатели динамики составляют +22% и +8% соответственно (рис. 1).
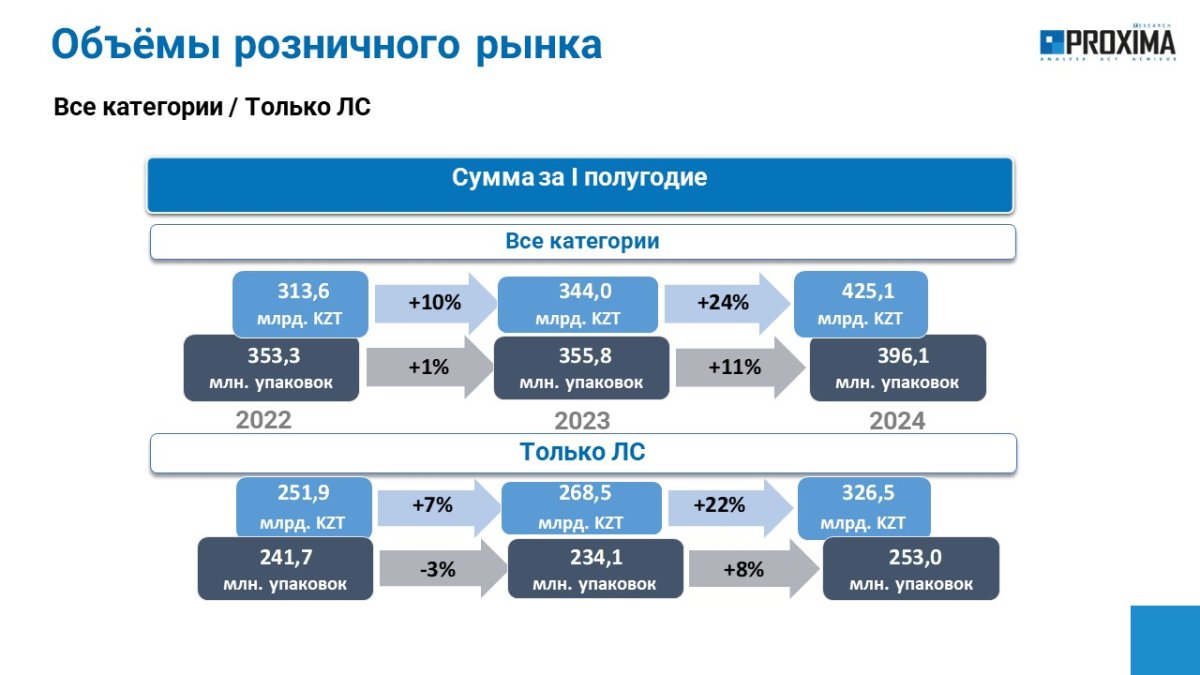
Рис. 1. Объем розничной реализации товаров «аптечной корзины» и отдельно лекарственных средств в денежном и натуральном выражении, по итогам I полугодия 2022–2024 гг. с указанием темпов прироста/снижения по сравнению с аналогичным периодом предыдущего года.
По итогам I полугодия 2024 г., лидерами среди аптечных сетей по товарообороту стали «БИОСФЕРА», «ЗЕРДЕ-ФАРМА» и «РАУЗА-АДЕ» (рис. 2). По состоянию на июнь 2024 г. наибольшая аптечная сеть владеет 382 аптеками и аккумулирует 7,35% общего товарооборота. В разрезе регионов, лидерами по среднемесячному товарообороту аптечных сетей за период январь-июнь 2024 г. являются г. Алматы, г. Астана и г. Шымкент (рис. 3).
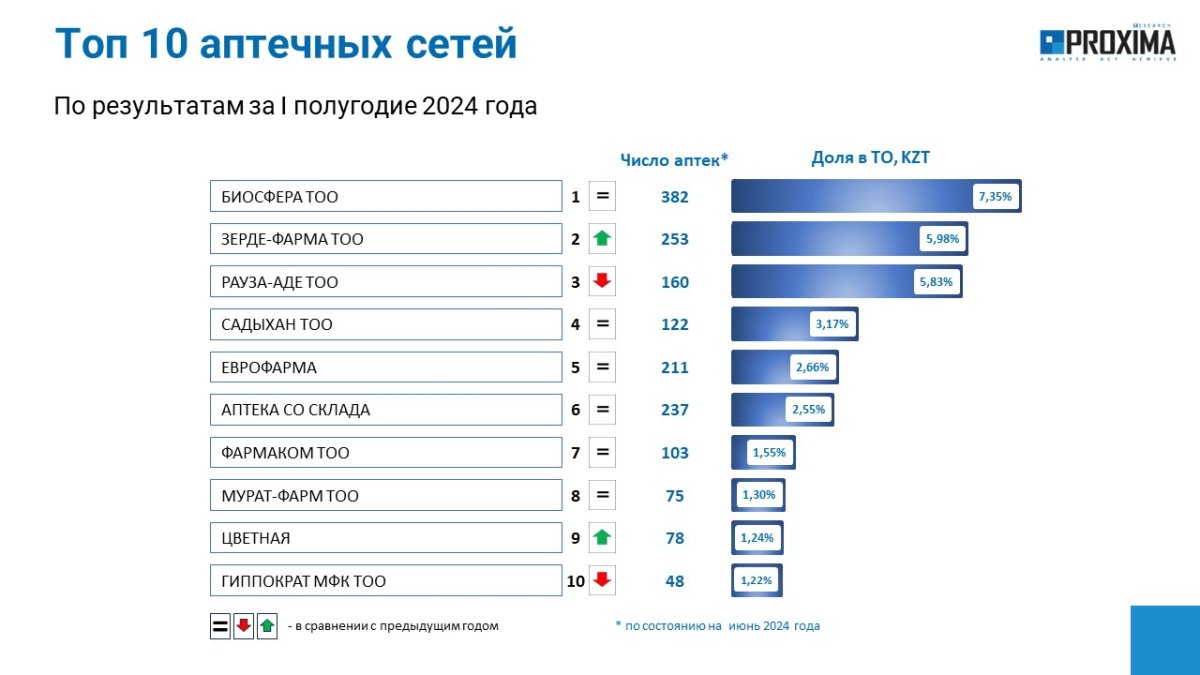
Рис. 2 Топ-10 аптечных сетей по товарообороту по итогам I полугодия 2024 г.
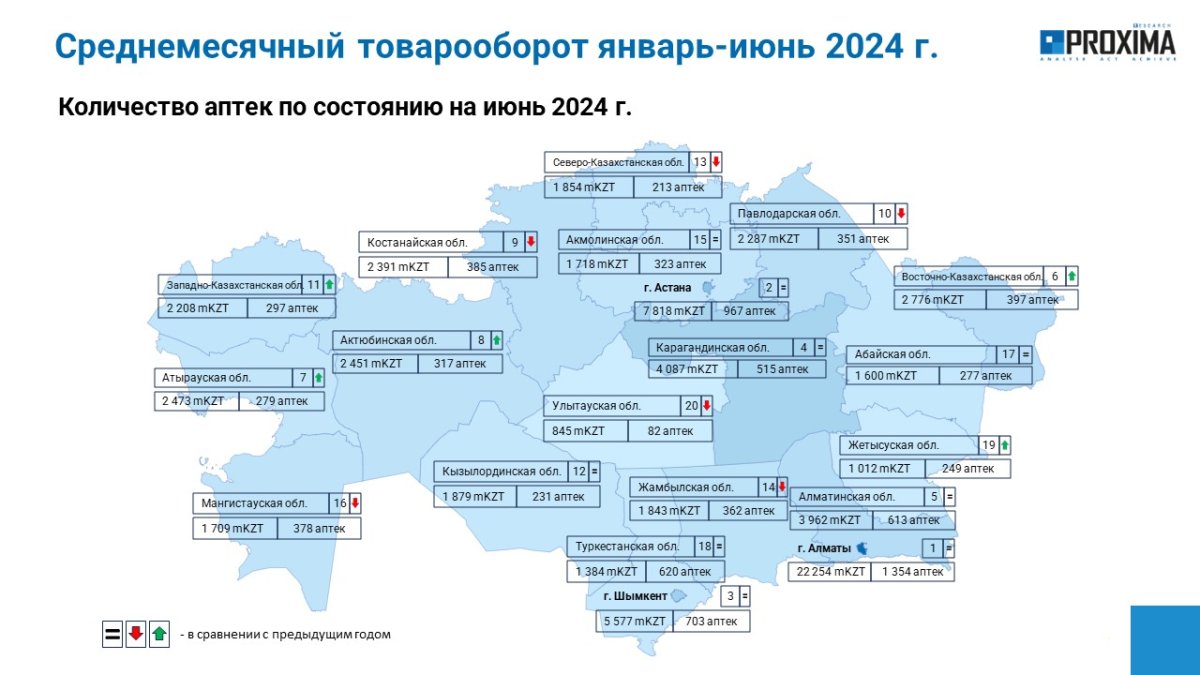
Рис. 3. Среднемесячный товарооборот аптек в разрезе регионов январь-июнь 2024 г. и количество аптек по состоянию на июнь 2024 г.
Согласно прогнозам аналитиков компании «Proxima Research International», во II полугодии 2024 г. темпы роста розничных продаж лекарственных средств замедлятся, а возможно даже и начнут снижаться. Однако, по итогам 2024 г., ожидается рост рынка розничной реализации лекарственных средств примерно на 10% по базовому сценарию (рис. 4).
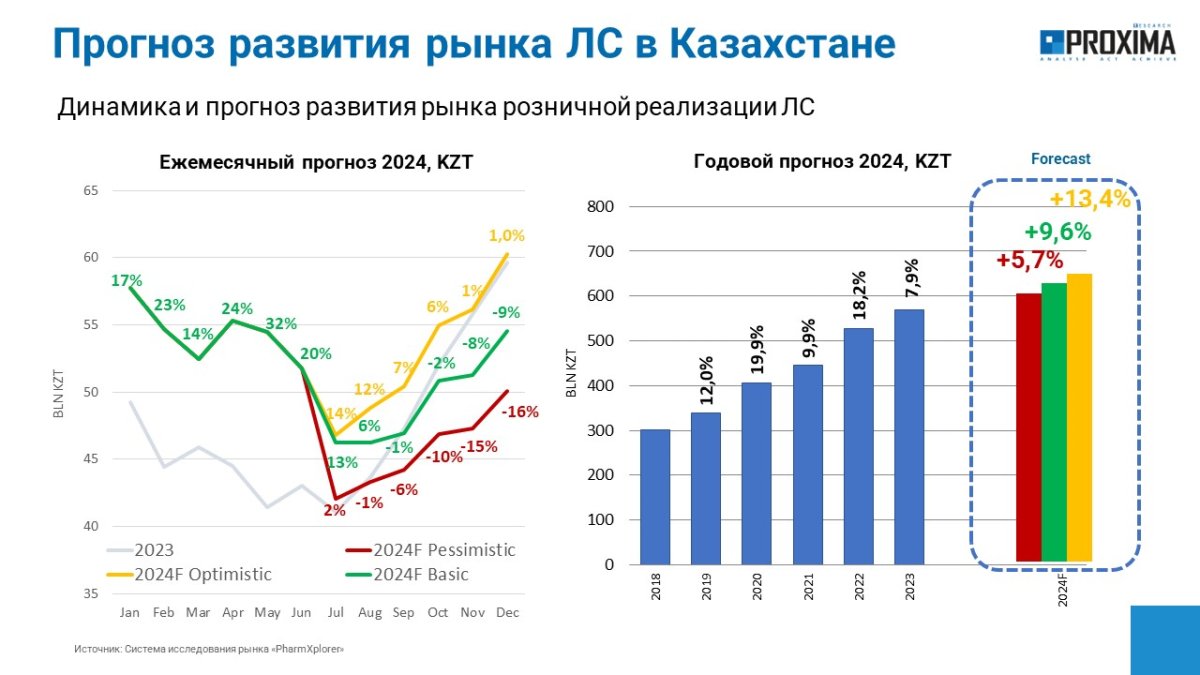
Рис. 4. Прогноз развития рынка лекарственных средств Республики Казахстан в национальной валюте
Профессионалы компании «Proxima Research» всегда придут на помощь клиентам, проведут специализированные маркетинговые исследования любой сложности и окажут консультационные услуги. Помогут заглянуть в будущее фармацевтического рынка - по желанию заказчика сделают кратко-, средне- и долгосрочные прогнозы развития рыночной ситуации с учетом различных макроэкономических показателей. Благодаря такой поддержке фармкомпании смогут улучшать свои позиции на рынке, всегда владеть ситуацией и быть в тренде.
Контакты: https://proximaresearch.com/kz/ru/
E-mail:
Телефоны: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH
Анонсы событий
22-23 октября 2024 года - IV Международный фармацевтический форум «Global Pharm»
22-23 октября 2024 года в Астане состоится IV Международный фармацевтический форум «Global Pharm» и IV Международный фор
22-23 октября 2024 года в Астане состоится IV Международный фармацевтический форум «Global Pharm» и IV Международный форум по медицинской технике «MedTech».
Мероприятие организовывается общественным фондом «Silk way development fund» при поддержке Правительства РК и Министерства здравоохранения.
Форумы «Global Pharm» и «MedTech» станут платформами для обмена опытом, налаживания партнерских связей и обсуждения новых возможностей для сотрудничества. Ожидается участие более 300 оффлайн и более 2000 онлайн делегатов из разных стран, что делает это событие важной вехой для укрепления сотрудничества в области здравоохранения.
Главная цель – способствовать привлечению государственных и частных инвестиций в развитие фармацевтического производства в Казахстане, наращивание научного и кадрового потенциалов, увеличение экспорта отечественной фармацевтической продукции, а также оснащение качественной и современной медицинской техникой организаций здравоохранения страны.
Среди спикеров – представители Министерства здравоохранения РК, ТОО «СК-Фармация», Комитета медицинского и фармацевтического контроля МЗ РК, Национального центра экспертизы лекарственных средств и медицинских изделий, а также общественные медицинские организации и сообщества, международные фармацевтические компании BigPharma, отечественные фармпредприятия и других стран СНГ.
Один из ключевых моментов – онлайн круглый стол с участием Министерства здравоохранения РК и представителей иностранных компании – мировых производителей, таких как Johnson&Johnson, Biocad, Takeda, Novartis, Nobel, Santo, Stada.
Мероприятие пройдет в г.Астана в Школе медицины Назарбаев Университета (улица Керей-Жанибек хандар 5/1), онлайн – на интеллектуальной платформе E-forum.net.
10 000+ специалистов фармотрасли выбирают Pharmtech & Ingredients
Ежегодно Pharmtech & Ingredients посещают представители лидирующих фармацевтических компаний в составе первых лиц, пр�
Ежегодно Pharmtech & Ingredients посещают представители лидирующих фармацевтических компаний в составе первых лиц, принимающих решения о закупках, а также специалисты, которые непосредственно работают с оборудованием и сырьем: технологи-проектировщики, инженеры-механики, наладчики технологического оборудования, директора по качеству, сотрудники исследовательских и аналитических лабораторий.
Какие ставят перед собой цели посетители выставки и к каким результатам это приводит?
• 63% находят новых поставщиков / партнеров по бизнесу
• 91% проводят встречи с существующими поставщиками / партнерами по бизнесу
• 78 % знакомятся с новыми продуктами и услугами
• 80% получают консультации и общаются с экспертами
• 77% посещают мероприятия деловой программы
• 63% изучают выставку с целью участия со стендом в следующем году
Посетители особенно ценят возможность вживую ознакомиться и оценить качество представленной продукции и оборудования, получить консультации по использованию оборудования напрямую от технических специалистов компаний-производителей. В этом году выставка станет самой масштабной за все время проведения выставки. На площади свыше 10 000 кв. м более 500 участников экспозиции представят свою продукцию.
«Сейчас значение этой выставки особенно велико, поскольку многие заказчики сомневаются в том оборудовании, которое появляется на нашем рынке. Чаще заказчик, принимая решение о контракте, ищет очной встречи на выставке. Новые контакты переходят в договорные отношения и сотрудничество. Крупные проекты чаще всего именно выставка помогает поддержать и развить», - отметил Павел Мынкин, директор по развитию компании REATORG.
Оцените сами коммерческую эффективность от посещения выставки. На Pharmtech & Ingredients вы найдете все для решения своих бизнес-задач: широкий ассортимент современного оборудования и технологий, эффективный нетворкинг, инновации и актуальную рыночную информацию.
19-22 ноября, Крокус Экспо, 2 Павильон, залы 6,7 и 8.
10 700 кв. м. площади, 500 + участников, 6 мероприятий деловой программы
С 29 октября по 29 ноября 2024 года состоится онлайн-курс «Практика разработки протокола неинтервенционного исследования»
С 29 октября по 29 ноября 2024 года компания Sciencefiles, 14 лет специализирующаяся на комплексном сопровождении разра�
С 29 октября по 29 ноября 2024 года компания Sciencefiles, 14 лет специализирующаяся на комплексном сопровождении разработки и регистрации лекарственных средств и медицинских изделий, приглашает вас принять участие в онлайн-курсе «Практика разработки протокола неинтервенционного исследования».
Уникальное преимущество онлайн-курса - ориентация на формирование практических навыков разработки протокола неинтервенционного исследования. Для этого в ходе курса участники выполняют проектное практическое задание с обязательной индивидуальной развернутой обратной связью от 3 тренеров курса.
Программа онлайн-курса включает 7 живых вебинаров по 7 темам:
• Неинтервенционные исследования: определения, цели, литературный поиск, протокол
• Неинтервенционные исследования: документы исследования, дизайны исследований, систематические ошибки
• Дата менеджмент и его особенности в неинтервенционных исследованиях
• Биостатистика: как расчитать выборку
• Биостатистика: как посчитать статистический анализ
• Контроль качества неинтервенционных исследований, публикации по результатам. Типичные ошибки планирования, проведения и оценки результатов
• Сессия: вопросы и ответы.
Подробная программа курса доступна на сайте.
Курс будет максимально полезен:
• Медицинскому писателю и медицинскому советнику;
• Руководителю и специалистам отдела пострегистрационных исследований, отдела регистрации и отдела фармаконадзора;
• Биостатистику и медицинскому статистику.
Тренеры курса:
Эксперты-практики - медицинский писатель, биостатистик и дата менеджер компании Sciencefiles с совокупным экспертным стажем более 46 лет, кандидаты медицинских, фармацевтических и биологических наук. Тренеры корпоративного университета компании, которые прошли обучение различным аспектам клинических исследований в Harvard Medical School, Royal Holloway, University of London, Society for Clinical Data Management и Global Health Network.
Отправьте заявку на участие в курсе на сайте.
О компании
С момента основания в 2009 году Sciencefiles успешно завершила более 1500 проектов для 165 фармкомпаний и контрактно-исследовательских организаций из России, стран ЕАЭС и ЕС, в том числе для 9 компаний из ТОП-20 Global Pharma. В портфолио компании сопровождение свыше 640 клинических исследований по 900 МНН, в том числе более 80 проектов по неинтервенционным исследованиям.
Регистрируйтесь на курс на сайте.
Не пропустите крупнейшую за всю свою историю выставку Pharmtech & Ingredients 2024
Не пропустите крупнейшую за всю свою историю выставку Pharmtech & Ingredients 2024. Более 400 участников из 8 стран в 3-х тема
Не пропустите крупнейшую за всю свою историю выставку Pharmtech & Ingredients 2024. Более 400 участников из 8 стран в 3-х тематических разделах.
Продолжается подготовка к ведущей в России и странах ЕАЭС выставке оборудования, сырья и ингредиентов Pharmtech & Ingredients. Экспозиция 2024 года превышает 10 700 кв.м. и станет самой масштабной за 26 лет проведения выставки, впервые заняв 3 выставочных зала.
Не упустите возможности в этом году ознакомиться с самым широким ассортиментом современного оборудования, сырья и технологий для фармацевтической промышленности. Предварительную регистрацию уже прошли специалисты из 49 регионов России и 19 стран.
БОЛЕЕ 500 ОТЕЧЕСТВЕННЫХ И ЗАРУБЕЖНЫХ ПРОИЗВОДИТЕЛЕЙ И ПОСТАВЩИКОВ ПРЕДСТАВЯТ:
- Производственное и непроизводственное оборудование - Sinopharmtech, ArtlifeTechno, Schematic, Tofflon, TRUKING TECHNOLOGY, VELENA PHARM, CANAAN, ТЕХНОФИЛЬТР, ГК Фармтех, ИТОРЧ, РОЛСТЕК и многие другие.
- Оборудование для лабораторий - РЕАТОРГ, Sinopharmtech, КАТРОСА Реактив, МИЛЛАБ, ФИЗЛАБПРИБОР, Sabiha Research & Development, Keno Pharma, ASA Biotech, Хеликон, Wiggens, Диаэм, Завод химико-технологического оборудования, MEMBRANE SOLUTIONS, ВЛАДИСАРТ, AСЕПТИКА и многие другие.
- Сырье и ингредиенты - BIOGROWING,HETERO, Anmol Chemicals, Boai NKY Pharmaceuticals Ltd., Laboratory Standards, ТД КРАСНАЯ ЗВЕЗДА, Megafine Pharma Ltd., BIOGRUND, , ХАРКЕ РУС, ХИММЕД и многие другие.
- Упаковочное оборудование и материалы - ECI Packaging, OMAG, ЭРЕКТОН, Белмедстекло, Друк Сервис, POLO RUSSIA, SHOTT, Завод , Гай-Комплект, Абсолют Типография, СВЕТ, Магикон и К, Ульма Пакаджинг, Дмитровский завод гибкой упаковки, PHARMAPACK TECHNOLOGIES , и многие другие.
- Технологии для производства косметической продукции – Велфарм, Завод Протей, Химброкер, Гай-Комплект, Биолит, Артлайф, АЛЬДОСА, BENEPURE PHARMACEUTICAL, InterPharmTechnology и многие другие.
Более 70 компаний примут участие в выставке впервые. В их числе: iTechno Group, ЛЕНПИПЕТ, VIRUPAKSHA ORGANICS LIMITED, БУСТЕР РУС, ГАРАНТ РСК, ГК ЕТС, Софринские Упаковочные Мануфактуры, Полисинтез, Brayden Trading и многие другие.
Посетив Pharmtech & Ingredients, вы сможете за короткий срок вживую изучить самый широкий в России ассортимент современного оборудования, сырья и технологий для фармацевтического производства и найти новых партнёров и поставщиков.
НОВОСТИ ДЕЛОВОЙ ПРОГРАММЫ
На сайте выставки опубликовано расписание запланированных деловых мероприятий.
В рамках пленарной сессии «Фарма будущего: как новые технологии влияют на производство фармацевтической продукции» вместе с экспертами обсудим применение искусственного интеллекта и цифровых технологий в фармпромышленности и актуальность общемировых трендов для российской фармацевтической отрасли. Ключевые темы прошлого года — производство АФС, рынок БАДов в России, получат свое продолжение в рамках деловой программы 2024, отразив актуальное состояние данных направлений и прогресс, которого отрасль смогла достичь за прошедшее время. Впервые прозвучат вопросы, связанные с производством ветеринарных препаратов в России. Следите за обновлениями на сайте, программа формируется.
Посещение мероприятий деловой программы бесплатно по билету на выставку.
ЖДЕМ ВАС 19-22 НОЯБРЯ НА PHARMTECH & INGREDIENTS!
26 сентября состоится онлайн-вебинар по практике неинтервенционных исследований
26 сентября в 15:00 (по мск) компания Sciencefiles приглашает принять участие в открытом онлайн-вебинаре «Время RWD/RWE: ак
26 сентября в 15:00 (по мск) компания Sciencefiles приглашает принять участие в открытом онлайн-вебинаре «Время RWD/RWE: актуальная практика неинтервенционных исследований». На вебинаре своей экспертизой поделятся ведущие медицинский писатель, проектный менеджер и биостатистик компании Sciencefiles.
В программе вебинара:
- Неинтервенционные исследования: настоящее и будущее
- Дизайны протоколов неинтервенционных исследований: какой выбрать?
- Дата менеджмент и его наиболее значимые особенности в неинтервенционных исследованиях
- Достоинства и недостатки РКИ и НИИ: взгляд биостатистика.
Участие бесплатное, по предварительной регистрации.
Вебинар будет особенно полезен:
+ представителям отделов маркетинга фармкомпаний
+ руководителям и специалистам отделов КИ в фармкомпаниях и CRO
+ медицинским советникам, медицинским писателям, биостатистикам, клиническим фармакологам.
Регистрируйтесь по ссылке.
10 октября 2024 года состоится вебинар по управлению эффективностью медпредставителей
Компания Proxima Research приглашает вас на эксклюзивный вебинар для руководителей внешних служб и маркетинга фарм�
Компания Proxima Research приглашает вас на эксклюзивный вебинар для руководителей внешних служб и маркетинга фармацевтических компаний Казахстана и Узбекистана: «Управление эффективностью медицинских представителей: как правильно настроить и использовать KPI».
Присоединяйтесь к нам онлайн 10 октября 2024 года с 11:00 до 12:00, чтобы узнать, как с помощью количественных и качественных показателей усилить позиции вашей компании на рынке и достичь новых бизнес-вершин.
Темы вебинара:
1. Количественные KPI: как настроить работу команды на результат.
Узнайте, как использовать такие показатели, как количество визитов, охват территории и специалистов, а также мультиканальное покрытие для оценки и оптимизации промоционных циклов.
2. Качественные KPI: оценка эффективности стратегии.
Оцените, как качественные показатели работы внешней службы помогают лучше понять восприятие ваших продуктов на рынке и наладить взаимодействие с медицинскими специалистами. Эти показатели позволяют корректировать стратегии для достижения лучших результатов.
Участие бесплатное, предварительная регистрация обязательна: https://pharmaevents.proximaresearch.com/ru/event-283/pr/kpi-mr-10-10.
Присоединяйтесь к вебинару, чтобы получить актуальные инсайты и повысить эффективность вашей команды!





















